Адрес этой статьи в интернете: www.biophys.ru/archive/spb2013/proc-p16.htm
АНТИРАДИКАЛЬНАЯ АКТИВНОСТЬ ВОДЫ С МОДИФИЦИРОВАННЫМ ИЗОТОПНЫМ СОСТАВОМ
Джимак С.С., АрцыбашеваО.М., БарышевМ.Г., Басов А.А.1
Кубанский Государственный Университет, Краснодар,Россия, jimack@mail.ru
1Кубанский Государственный Медицинский Университет Минздравсоцразвития, Краснодар
В плазме крови человека и животных содержание дейтерия немного превышает его содержание в питьевой воде и составляет в зависимости от региона проживания 140-160 ppm. Вода с модифицированным изотопным составом с пониженным содержанием дейтерия (ВМИС ССД) предположительно позволяет проводить профилактику и коррекцию окислительного стресса и соответственно контролировать образование свободных радикалов в организме [1].
Целью настоящего исследования являлось влияния количественного содержания дейтерия в плазме крови и органах лабораторных животных на интенсивностьсвободнорадикального окисления методами ЯМР, ЭПР и масс-спектрометрии в физиологических условиях и при воспалительных процессах.
Одним из наиболее удобных методов для измерения дейтериевого состава плазмы крови является ЯМР спектроскопия [2]. Однако, этот метод не позволяет измерить содержание дейтерия в тканях органов лабораторных животных. Эта задача была решена при помощи изотопного масс-спектрометра.
Измерение спектров ЭПР проводили при комнатной температуре на спектрометре JESFa 300 (JEOL, Япония) в X-диапазоне. Воду с пониженным содержанием дейтерия получали на установке, разработанной в Кубанском государственном университете [3]. Исходная концентрация дейтерия в получаемой воде составляла 40 ppm.
Определение концентрации дейтерия в биологических жидкостях были проведены на импульсном ЯМР спектрометре JEOL JNM-ECA 400MHz.Для определения изотопного состава лиофилизированных органов лабораторных животных использовался масс-спектрометр DELTAplus, снабженный периферийным устройством для пробоподготовки воды к изотопному анализу водорода H/Device (Finnigan, Германия).
|
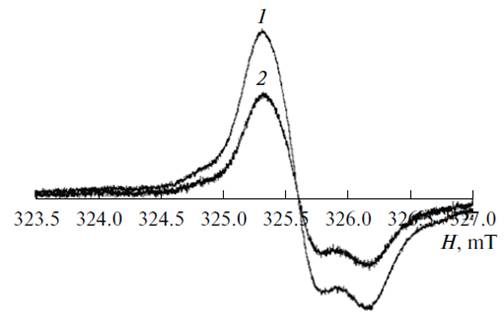
Рис. 1. Спектры ЭПР лиофилизированных тканейсердца лабораторных мышей контрольной (1) и опытной группы (2), употреблявшей ВМИС ССД 40 ppm, после 4 недель |
Для эксперимента использовали 3 группы крыс по 20 штук в каждой группе. Первая группа – контрольная, в которой крысы употребляли дистиллированную минерализованную воду. Во второй группе крысы употребляли дистиллированную минерализованную воду с содержанием дейтерия 40 ppm. В третьей группе крысы употребляли дистиллированную минерализованную воду с содержанием дейтерия 100 ppm. В течение 3 недель раз в неделю забивали двух крыс из каждой группы с целью определения содержания дейтерия в плазме крови. Через 3 недели с начала эксперимента вызывали окислительный стресс моделированием гнойной раны у крыс, при этом, использовали двухэтапную модель окислительного стресса [4]. Через 4 недели с начала эксперимента крыс оставшихся крыс забивали, органы лиофилизировали, в лиофильной сушилке ЛС-1000 и определяли содержание парамагнитных центров на ЭПР спектрометре, а содержание дейтерия на масс-спектрометре.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Спектры ЭПР лиофилизированных образцов сердца лабораторных животных приведены на рисунке 1 и содержат анизотропный синглетный сигнал, параметры спин-гамильтониана (g^ = 2.0074, g÷ï= 2.003) которого соответствуют стабильным радикалам [5,6,7]. Спектры ЭПР образцов печени и почек имеют аналогичный характер.
У крыс, потреблявших воду с остаточным содержанием дейтерия 40 ppm, выраженный антиоксидантный эффект наблюдали уже в течение первой недели, в лиофилизированных органах (печени, почках, сердце) наблюдали снижение количества парамагнитных центров (по данным ЭПР) в исследуемых тканях примерно на 32-38% по сравнению с контрольной группой. Это свидетельствует об уменьшении количества свободных радикалов и подтверждает благоприятное воздействие легкой воды на организм животных. В то же время, у крыс, потреблявших воду с остаточным содержанием дейтерия 100 ppm, наблюдали менее выраженный антиоксидантный эффект: в лиофилизированных органах (печени, почках, сердце) наблюдали снижение количества парамагнитных центров (по данным ЭПР) в исследуемых тканях примерно на 24-27% по сравнению с контрольной группой.
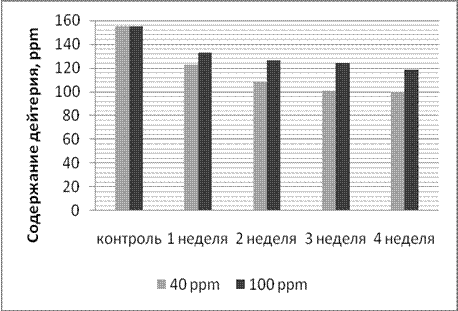
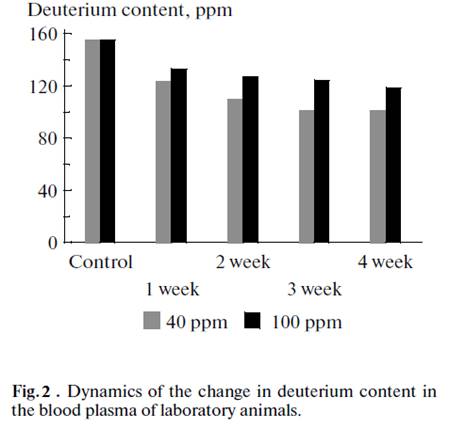
Динамика изменения содержания дейтерия в плазме крови лабораторных животных при потреблении воды с остаточным содержанием дейтерия 40 и 100 ppm в ходе эксперимента представлена на рисунке 2.
|
Рис. 2. Динамика изменения содержания дейтерия в плазме крови лабораторных животных |
Как видно из рисунка, содержание дейтерия в плазме крови лабораторных животных по данным ЯМР спектроскопии постепенно снижается и выходит на плато после 3 недели употребления ВМИС ССД.
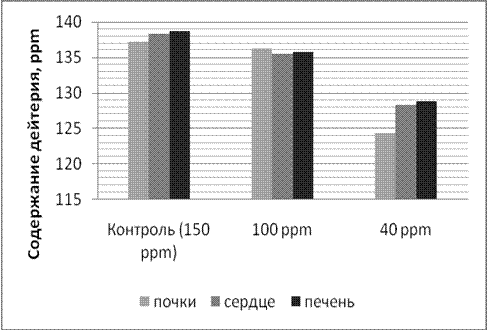
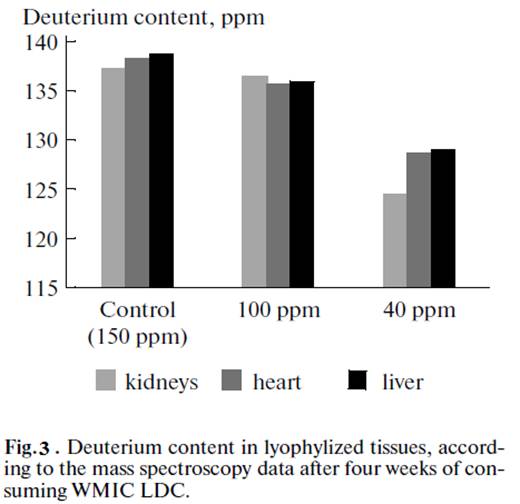
Содержание дейтерия в лиофилизированных тканях печени, почек и сердец лабораторных животных, употреблявших ВМИС ССД в течение месяца представлены на рисунке 3.
Из рисунков 2 и 3 видно, что при употреблении воды с более низкой концентрацией дейтерия, его концентрация снижается до более низкого уровня в плазме и тканях. Однако, и в случае употребления воды с концентрацией 100 ppm и 40 ppm наблюдали выход на плато концентрации дейтерия в плазме и органах через 3 недели после начала употребления ВМИС ССД.
Согласно данным ЭПР спектроскопии, вода с остаточным содержанием дейтерия 40 ppm обладает более быстрым развитием антиоксидантного эффекта при развитии гнойно-воспалительных заболеваний у лабораторных животных.
ЗАКЛЮЧЕНИЕ
Таким образом, в работе на основе современных методов спектроскопии проведен анализ изменения содержания дейтерия в плазме и лиофилизированных тканях органов лабораторных животных. Методом ЭПР спектроскопии определено, что количество парамагнитных центров в исследуемых лиофилизированных тканях сердца, печени, почекВМИС ССД, уменьшилось на 24-38% по сравнениюс контрольной группой в зависимости от концентрации дейтерия в употребляемой воде.Это свидетельствует о значительном влиянии малых колебаний концентрации дейтерия в окружающей среде на адаптационную способность организма.
Работа выполнена при поддержке государственного задания Министерства образования и науки Российской Федерации, проекты № 4.1755.2011, № 7.369.2011.
|
Рис. 3. Содержание дейтерия в лиофилизированных тканях по данным масс-спектроскопии после 4 недель употребления ВМИС ССД |
Литература
1. Olariu L. et. al.Lucrăriştiinłificemedicinăveterinară vol. XLIII (2). 2010.
2. Барышев М.Г. и др.// Экологический Вестник научных центров ЧЭС. Вып. 3. 2011.
3. Барышев М. Г. и др.// Наука Кубани. №3. 2010.
4. Басов А.А. и др.«Способ хирургического моделирования окислительного стресса у лабораторных животных». Положительное решение о выдаче патента на изобретение по заявке № 2011100352/14 (000483) от 11.01.2011.
5. Современные методы биофизических исследований. / под ред. А.Б. Рубина. М.: Высшая школа, 1988.
6. Боровик Е.С. и др.Лекции по магнетизму. М.: Физматлит, 2005.
7. Пулатова М.К. и др. Электронный парамагнитный резонанс в молекулярной радиобиологии. М.: Энергоатомиздат, 1989.
ANTIRADICAL ACTIVITY OF WATER WITH MODIFIED ISOTOPE COMPOSITION
Dzhimak S.S., Artcibasheva O.M., Barishev M.G., Basov A.A.1
Kuban State University, Krasnodar, Russia, jimack@mail.ru
1Kuban State Medical University Minzdravsotsrazvitiya, Krasnodar, Russia
Electron paramagnetic resonance (EPR) is widely used to solve a number of physicobiological problems. It is also the main method for studying paramagnetic particles in biological systems. Free radicals are paramagnetic particles of biological importance. They help to regulate many intracell processes, including immune mechanisms, the neutralization of xenobiotics, apoptosis, and the metabolism of biologically active compounds. One promising foodstuff for adjusting the antioxidant potential of an organism is water with modified isotope composition (WMIC), e.g., water with a reduced deuterium content [1, 2].
Substituting ordinary water for heavy lowers the electrical conductivity of electrolyte solutions due mainly to an increase in viscosity and thus a reduction in ion mobility. Heavy water mainly affects the active properties of an excitable membrane. The presence of deuterium in biological systems leads to changes in the structure and properties of DNA and proteins. At a 30% substitution of ordinary water for heavy, the life processes of microorganisms stop and mammals (e.g., laboratory rats) die [3, 4].
In the plasma of human and animal blood, the deuterium content slightly exceeds its content in drinking water and is 140–160 ppm, depending on the habitat. Water with modified isotope composition and a lowered deuterium content (WMIC LDC) supposedly allows us to perform preventive maintenance and correct oxidative stress, and thus to control the formation of free radicals in an organism [5, 6]. The aim of this study was to study the effect of the quantitative deuterium content in the blood plasma and organs of laboratory animals on the intensity of freeradical oxidation by NMR, EPR, and mass spectrometry under the physiological conditions and in inflammatory processes.
One of the most convenient methods for measuring the deuterium composition of blood plasma is NMR spectroscopy. However, this method does not allow us to measure the deuterium content in the tissues of laboratory animal organs. This problem was solved using an isotope mass spectrometer. EPR spectra were registered in the X band at room temperature on a JES FA spectrometer 300 (JEOL, Japan). Water with reduced deuterium content was obtained on a setup designed at Kuban’ State University [3]. The initial deuterium concentration in the water was 40 ppm. The deuterium concentration in biological liquids was determined on a JNM_ECA 400MHz pulse NMR spectrometer (JEOL). The isotope composition of lyophilized organs of laboratory animals was determined on a DELTA plus mass spectrometer (Finnigan, Germany).
|
|
Three groups of rats (20 in each group) were used in our experiment. The first was the control group, in which rats drank distilled mineralized water. In the second, the rats drank distilled mineralized water with a deuterium content of 40 ppm. In the third, the rats drank distilled mineralized water with a deuterium content of 100 ppm. Once a week for three weeks, two-rats from each group were euthanized to determine the deuterium content in the blood plasma. Three weeks from the beginning of the experiment, oxidative stress was stimulated by simulating a festering wound in the rats, using a two stage model of oxidative stress. Four weeks from the beginning of the experiment, the rest rats were euthanized; their organs were lyophilized in an LS_1000 lyophilic dryer, and the paramagnetic center and deuterium contents were determined on an EPR spectrometer and a mass spectrometer, respectively.
RESULTS AND DISCUSSION
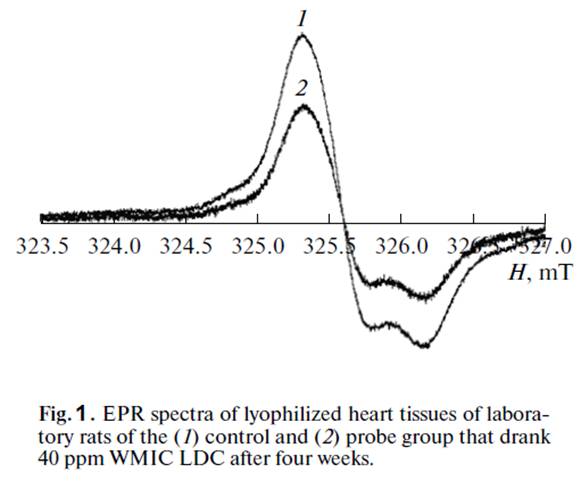
EPR spectra from lyophilized heart samples of laboratory animals are presented in Fig. 1. They contain an anisotropic singlet signal, the spin Hamiltonian parameters of which (g⊥ = 2.0074, gII = 2.003) correspond to stable radicals [7].
The EPR spectra of the liver and kidney samples were of a similar nature. A pronounced antioxidative effect in the rats that drank water with a residual deuterium content of 40 ppm was observed as early as the first week.
|
|
In lyophilized organs (liver, kidneys, heart), the number of paramagnetic centers (according to the EPR data) fell by approximately 32–38%, relative to the control group. This indicates a slowdown in the reduction of the free radical numbers and confirms the favorable effect of light water on the organism of animals. At the same time, a less pronounced antioxidative effect was observed in rats that drank water with a residual deuterium content of 100 ppm: in lyophilized organs (liver, kidneys, heart), the number of paramagnetic centers (according to the EPR data) fell by approximately 24–27%, relative to the control group.
The dynamics of the change in the deuterium content during the experiment in the blood plasma of laboratory animals consuming water with residual deuterium contents of 40 and 100 ppm is shown in Fig. 2. It can be seen from in the figure that the deuterium content in the blood plasma of laboratory animals according to the NMR spectroscopy data gradually declines and reaches a plateau after three weeks of using WMIC LDC.
The deuterium content in the lyophilized tissues of liver, kidneys, and heart of laboratory animals that drank WMIC LDC for a month is given in Fig. 3. It can be seen from Figs. 2 and 3 are that the deuterium concentration fell to a lower level in plasma and tissues when water with a lower deuterium concentration was consumed. When water with deuterium concentrations of 100 ppm and 40 ppm was consumed, however, the plateau of deuterium concentrations in plasma and organs was reached in three weeks after the first use of WMIC LDC. According to the EPR spectroscopy data, water with a residual deuterium content of 40 ppm reveals faster development of the antioxidative effect during the development of festering inflammatory diseases in laboratory animals. This is related to a sharp increase in the immunity and resistivity of the organism.
|
|
CONCLUSIONS
The change in the deuterium content in the plasma and lyophilized tissues of organs of laboratory animals was analyzed on the basis of present day spectroscopy methods. EPR spectroscopy was used to find that, depending on the deuterium concentration in the consumed water, the number of paramagnetic centers in investigated lyophilized tissues of heart, liver, and kidneys in the case of WMIC LDC fell by 24–38%, relative to the control group. This testifies to the considerable effect of small fluctuations in the concentration of deuterium in the surrounding medium on the ability of an organism to adapt.
ACKNOWLEDGMENTS
This work was supported by the RF Ministry of Education and Science Grant nos. 4.1755.2011, 7.369.2011.
REFERENCES
1. Olariu, L., et al., Lucr ri Stiin ifice Medicin Veterinar , 2010, vol. 43, no. 2.
2. Baryshev, M.G., et al., Ekologich. Vestn. Nauchn. Tsentrov ChES, 2011, no. 3.
3. Baryshev, M.G., et al., Nauka Kubani, 2010, no. 3, p. 18.
4. Basov, A.A., RF Patent Application 2011100352/14 (000483) IPC G01N33/48, 2012
5. Sovremennye metody biofizicheskikh issledovanii (Modern Methods in Biophysical Researches), Rubin, A.B., Ed., Moscow: Vysshaya shkola, 1988.
6. Borovik, E.S., et al., Lektsii po magnetizmu (Lectures on Magnetism), Moscow: Fizmatlit, 2005.
7. Pulatova, M.K., et al., Elektronnyi paramagnitnyi rezonans v molekulyarnoi radiobiologii (Electron Paramagnetic Resonance in Molecular)