Адрес этой статьи в интернете: www.biophys.ru/archive/congress2012/proc-p99-1-d.htm
МОДЕЛЬ ВЗАИМОДЕЙСТВИЯ ЭНЕРГИИ МОЛЕКУЛ ВОДЫ, ИОНОВ И БЕЛКА МНОГОСЛОЙНОЙПОЛЯРИЗОВАННОЙ СТРУКТУРЫ ЭУКАРИОТОВ
Вапняр В.В.
ФГБУ Медицинский радиологический научный центр Минздравсоцразвития РФ, Обнинск, Россия, vap@obninsk.com
Цель работы - разработать модель сопряженной связи биофизических и биохимических процессов с реализацией энергии молекул белка, воды и ионов при гидратации и метаболизме в эукариотах.
Предпосылка. Согласно мембранной теории, вода выступает в роли растворителя неорганических и органических соединений в тканях. Смещение равновесия молекул растворителя и растворенного вещества зависит от изменения температуры, давления, а также концентрации какого-либо реагента (принцип Ле-Шателье-Брауна). Образование соединений молекул растворенного вещества с жидким растворителем постоянного или переменного состава, характеризуют свойства растворов, определяемое энергией их взаимодействия. Для водных растворов электролитов и не электролитов характерно межмолекулярное, тепловое движение с образованием короткоживущих группировок молекул. Общая теория для электролитов в настоящее время еще не разработана. Однако, согласно общим положениям, в растворах степень диссоциации анионов и катионов определяется их силой и природными свойствами, а также диэлектрической проницаемостью растворителя. В растворах электролитов ионы способны стабилизировать или разрушать водные структуры. Близкие по природе молекулы образуют неустойчивые группы (ассоциаты), которые оказывают существенное влияние на физико-химические свойства растворов. Так ионные пары образованы электростатическим взаимодействием одинаково или противоположно заряженными ионами могут быть контактными или разделенными растворителем.
Взаимодействие частиц с растворителем (сольватация) обусловлена силами Ван-дер-Ваальса, водородной связью, координационными связями. Гидратация, как частный случай сольватации, представляет взаимодействие вещества с ионами, имеющими высокий заряд, возрастающий при нарастании концентрации растворителя. Изучая эффекты "гидратации” и “дегидратации” в качественном плане исследователи пришли к выводу, что наименьшие гидратированные катионы теряют водные молекулы первыми [1], тогда как до этого бытовало мнение о преимущественной их потере с наиболее гидратированных оболочек [2]. Для количественной оценки они вносили эффекты диэлектрического насыщения в “гидратированные диаметры ионов”, которые вызывают колебание с изменением ионных мест (сайтов). При этом гидратация ионов характеризуется их величиной, относительным весом и подвижностью, представленная в лиотропных рядах или рядах гидратации Гофмейстера, где ионы располагаются по пониженной степени гидратации: катионы: Li+ - Na+ - K+ - Rb+ - Cs+ - Ca 2+ - Sr 2+ - Be2+ , анионы: SO4-- - Cl- - Br - -NO2- - J - - CN5 -. При диаметре водной молекулы равной 2,7 Ао, теоретическая кривая давала гидратированные диаметры катионов для Li + - 8,36 Aо, Na + - 7,0 Aо, K+ - 6,6 Aо, Rb+ - 5,6 Aо, Cs+ - 3,52 Aо. Тогда энергия для каждого катиона составляет: Li+ - 114,6 ккал/моль, Na+ - 89,7; K+ - 73,5; Rb+ - 67,5; Cs+ - 60,8 ккал/моль [3]). Однако только диэлектрическое насыщение ионов не позволяет наиболее полно представить их взаимодействие в водно-солевом растворе. Вводится также еще ряд других параметров, такие как поляризуемость, дипольные моменты, константа отталкивания Born, дающие различие в энергии гидратации. Совокупность таких параметров в конечном итоге формируют силы длительного взаимодействия, действующие на заряды через среду и вносящие вклад в поведение исследуемой структуры.
Следовательно, на взаимосвязь молекул воды и ионов в растворе влияют короткодействующие силы Ван-дер-Ваальса и дальнодействующие - гидродинамические и электростатические. Причем гидродинамические силы действуют на заряды через среду и вызывают возмущение броуновского движения частиц. Электростатические силы определяют взаимодействие зарядов.
1. Взаимодействие энергии молекул воды, белка и ионов в протоплазме эукариотов
Зарождение биоэлектрических и биомагнитных полей на уровне клетки объясняется рядом механизмов. В качестве биоэнергетического генератора выдвигается трансмембранный потенциал, составляющий разницу электрических потенциалов на внешней и внутренней поверхности мембраны клетки, используя структуру и свойства ряда клеток (нейронов, мышечных клеток др.)[4]. Мембрана клетки толщиной 5 нм, состоящая из липидов, считается хорошим изолятором [5]. Мембрана включает два типа белковых компонентов - один тип белка обеспечивает активный выход двух ионов натрия из клетки и вход трех ионов калия в клетку за счет энергии метаболизма и через АТФ-азу осуществляет работу натриевого насоса. Другой тип белка содержит каналы, через которые транспортируются ионы, создавая неоднородную поляризацию наружной поверхности мембраны. Регуляция в ионных каналах может осуществляться действием электрических токов, с учетом параметров тока и напряжения [6].
Внутриклеточная протоплазматическая структура, содержащая свободную и “связанную’ фракции воды, функционирует по модели быстрой диффузии протонов и способна активно участвовать в процессах жизнеобеспечения живой протоплазмы [7]. Свободная фракция представляет обычную воду, связанная – имеет тесную связь и взаимодействие водных и белковых молекул с ионами. Многослойная поляризованная структура связанной фракции воды состоит из кристаллированных и гидратированных слоев, имеющих различие в биофизических свойствах. Энергия энтропии, преимущественно развивающаяся в гидратированном слое воды, способствует быстрому обмену протонов между фракциями [8].
Находящийся на фибриллярной поверхности контактный слой воды, представляет волокнистые, плотно упакованные построения, в который проникают водные молекулы. В результате тесного сближения водные молекулы “обволакивают" фибриллярные построения и образуется новая структура, в виде корки, покрытой “льдом” или “решеточной гидратной оболочки” [9]. Высказывается также мысль о наличии в таких оболочках “структурной температуры”, которая значительно ниже, по сравнению с окружающей водой [10]. Этим подчеркивается, что такой слой по биофизической природе качественно отличается от других, прилежащих к нему слоев.
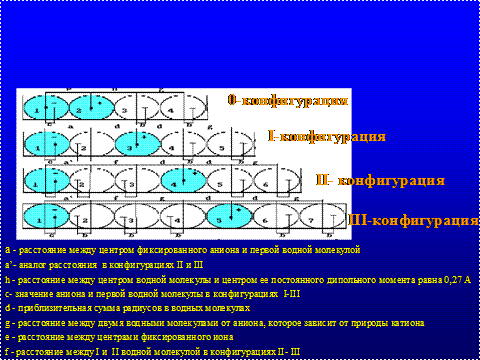
Теоретически и экспериментально Ling G. (1962) [11] доказывает, что живая протоплазма представляет трехмерную решетку протеина, воды и солей, способных мобилизоваться в фиксированно-зарядную систему (ФЗС) с помощью сил коротко- и дальнодействия. Силы взаимодействия в разведенных водно-солевых растворах проявляются избирательностью одного иона, по сравнению с другим, благодаря различию энергии ассоциации (адсорбции). Усиление средних ассоциативных участков может иметь ковалентную связь, а зарядное фиксирование увеличится при снижении в среднем ионной ассоциации. Наиболее полное взаимодействие между отдельными ионами и молекулами воды ФЗС показано через построение модели (рис.1).
|
|
|
Рис.1. Модель фиксировано-зарядной системы (Ling G.,1962)
|
Катион, анион и две молекулы воды, последовательно помещенных в воображаемую цилиндрическую полость, представляют 0-конфигурацию. Последующие I-III конфигурации будут отличаться наличием одной, двух и трех водных молекул, вставленных между катионом и анионом. Средняя дистанция от одного фиксированного иона до центра другого соседнего фиксированного иона составляет 20Ао. Установление определенных дистанций позволяет выявить равновесное расстояние между всеми исследуемыми частицами. Между катионом и анионом, разделенными водными молекулами, может иметь место наличие свободной энергии гидратации, обозначенной как константа диссоциации. Кислоты, содержащие одинаковые карбоксильные группы, могут иметь значительные различия константы диссоциации. Так для уксусной кислоты она составляет 4,7, а для трехуксусной кислоты – меньше единицы. В ФЗС развиваемые силы, проходящие через взаимодействующие молекулы при перераспределении протонов в таких функциональных группах, приравненных по своим значениям к константе диссоциации, развивают индуктивный эффект. Снижение плотности электронов за счет замещения атомов водорода отрицательными атомами (например, Cl) может приводить к отрицательному индуктивному эффекту. Замещение водорода электрон отрицательными группами высвободит электрон, увеличит электронную плотность и создаст положительный индуктивный эффект, который активно зависит от поляризации и других факторов [12]. Результирующим действием будет увеличение, снижение или отсутствие энергии взаимодействия между анионами и катионами. Отделение избыточного единичного электрона от катиона может быть выражено в ангстремах и условно обозначено дистанцией – С. Положительная дистанция С, если электрон смещается в сторону выбранного катиона и отрицательная – при смещении от него, что выявляет независимую природу катиона и точность его локализации. Определение С – значения представляет возможным вычислить все виды энергии короткого и длительного диапазона между противокатионами и фиксированным анионом при конкретном С – значении, где все промежуточные степени гидратации являются статистически определяемыми.
Комбинация диэлектрического насыщения, индуктивного эффекта, закономерное перемещение электронов на фиксированных ионных местах, степень их гидратации в различных сочетаниях с молекулами воды, вносят понятие о формировании внутренней энергии. Установлено аддитивное взаимодействие между дипольным моментом одной молекулы, анионом и катионом, отмечена активация между постоянными и индуцированными диполями. Комбинации этих эффектов, при уменьшении равновесных расстояний между взаимодействующими молекулами и ионами, ведет к усилению атомарных сил, включению энергии дисперсионного взаимодействия London. Суммируя все энергии, найденные между анионом и катионом, анионом и водными молекулами, а также между водными молекулами на абсолютной основе, позволяет найти энергию каждой конфигурации. Определенный вклад вносит также поляризация, представляющая взаимодействие отрицательно заряженных анионов и анионных групп, подключения к ним энергии от близлежащих атомов и других вторичных эффектов (рис.2).
|
|
|
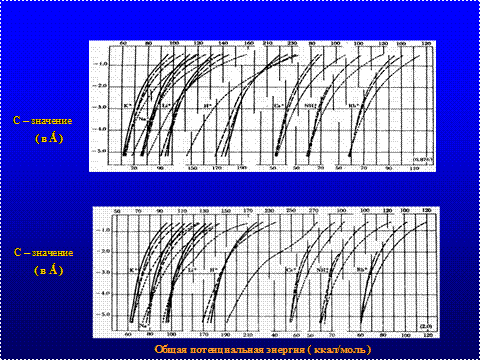
Рис.2 Изменение общей потенциальной энергии фиксировано-зарядной системы при функции С-значения, минимальной и максимальной поляризуемости аниона и энергии каждого катиона в конфигурациях. Значения нанесены для каждого катиона в конфигурации О-111(0---, I , II , III ____), (Ling, 1962). |
Нижний предел величины поляризации берется произвольно (составляет примерно 0,826 х 10–24 см3), и отражает приближенное усредненное значение для окислительных групп (карбоксильных, гидроксильных, эфирных и др.). Для верхнего предела величины поляризации взято значение 2,0 х 10 –24 см3, приблизительно равное значению для ОН - группы – 1,84 х 10 – 24 см3 [13]. Лингом рассчитано возрастание величины потенциальной энергии большинства ионов с увеличением гидратации в конфигурационных построениях и значений поляризации. Изменение общей потенциальной энергии фиксированно-зарядной системы с изменением потенциальной энергии, где фиксированный ион имеет поляризуемость 0,826 х 10–24 см3 (нижний предел вличины поляризации окислительных групп отражен на верхнем уровне рис. 2) и 2,0х1024см3 (верхний предел величины поляризации отражен на нижнем уровне рис. 2).
На графиках можно проследить за нарастанием энергетического состояния, например, для ионов водорода. Как видно, потенциальная энергия ионов водорода возрастает в наибольшей степени на уровне взаимодействия дегидратированных ионов (О-конфигурация), где высокая поляризация (2,0) и наименьшие С-значения дают подъем энергии от 190 ккал/моль до 270 ккал/моль. Такое взаимодействие свидетельствует не только о дополнительном вкладе энергии в каждый протон за счет энергии поляризации, но и об относительной его свободе по отношению к другим ионам, формирующим энергетические конфигурационные уровни исследуемой системы.
Распределение внутренней энергии в ФЗС будет зависеть от пространственного нахождения иона. При этом, чем слабее гидратирован ион, тем большей свободой действия он обладает. Хорошогидратные ионы фиксированы за счет сил развития внутренней энергии ассоциации. Большое различие в константе диссоциации указывает на значительное изменение в энергии гидратации взаимодействующих ионов.
Полная энергия иона рассчитывается, при определенном С-значении и О оК и учета оценки нулевой энергии каждого иона, молекул воды, их равновесных расстояний. Также включаются все виды энергии взаимодействия между зарядами, зарядом и постоянными диполями, зарядом и индуцированными диполями, энергией дисперсионного вращения London и энергией отталкивания Born. При этом вычитается величина n х 4,98 ккал/моль, где n – постоянное число молекул между катионом в конфигурации, а 4,98 ккал/моль соответствует энергии, необходимой для перемещения молекул воды между конфигурациями. Накопление энергии на энергетических уровнях до определенного предела в конечном итоге вызовет одномоментную перегруппировку под воздействием косвенного индуктивного эффекта, функционирующего по принципу “все или ничего”.
Имеет место также такая зависимость: при более низких С - значениях предполагается более высокая конфигурация с большим числом водных молекул, внедряющимися между катионом и анионом. Поведение гидратных ионов будет стремиться к порядку, характерному для лиотропного ряда – ионы с большими гидратными оболочками адсорбируются слабо, тогда, как ионы с наименьшими гидратными оболочками делают это более охотно. Высоту С-значения характеризуют сдвиг к низшим конфигурациям. Отмечается выраженная энергоемкость цитоплазмы для ионов. Энергоемкость таких ионов зависит от последовательности его перемещения и наличия “гидратированного” диаметра, составляющего сумму его радиуса с количеством диаметров водных молекул, находящихся около него. Так Li и Na предпочтут хорошогидратированные слои, тогда как K, NH4, Cs – средние и слабогидратированные уровни. Распределение внутренней энергии в ФЗС будет зависеть от пространственного нахождения иона, чем слабее гидратирован ион, тем большей свободой действия он обладает. Хорошогидратированные ионы фиксированы за счет сил внутренней энергии ассоциации. Большое различие в константе диссоциации указывает на значительное изменение в энергии гидратации взаимодействующих ионов. Энергия, возникающая между частицами, может составлять основу формирования общей энергоемкости связанной фракции воды не только в ее кристаллированном «льдоподобном» слое, но позволяет понять механизм функционирования больших популяций частиц в гидратированном слое, где содержатся молекулы воды и ионы порядка 1022 – 1023. Такие огромные популяции частиц могут обрабатываться статистической механикой, а анализ проводиться по энергетическим уровням в конфигурациях. Упорядочивание частиц строится по закону геометрической прогрессии, где предшествующий уровень содержит всегда меньше частиц, чем последующий. В частности, Ling рассчитал, что в слабогидратном слое (0- конфигурация) содержится 81% обменивающихся молекул, в I-м – 15%, во II-м – 3%, хорошогидратированый слой (III конфигурация) содержит их всего 1%, соответственно энергия катиона в них составляет 0-I – 1%, II – 4%, III – 95%.
Согласно теории Ling G многослойной организации поляризованной воды (теория МОПВ) структурированная вода в клетке, определяемая уровнем АТФ, находится в связанном состоянии и ограничивает диффузию свободных веществ не только внутри ее, но и выполняет барьерную функцию на поверхности клетки. ПРИРОДА ФИКСИРОВАННЫХ АНИОНОВ НА ПОВЕРХНОСТИ КЛЕТКИ ТАКАЯ ЖЕ, КАК И ВНУТРИ КЛЕТОК, ПОЭТОМУ ОБМЕН ВОДЫ И ИОНОВ МЕЖДУ КЛЕТКОЙ И СРЕДОЙ ОГРАНИЧЕН СПЛОШНОЙ СТРУКТУРИРОВАННОЙ ВОДОЙ КЛЕТКИ, А НЕ МЕМБРАНОЙ. Здесь также избирательно адсорбируются К+ в присутствии Na+, как это происходит в цитоплазме. Это положение подтверждено многочисленной серии проведенных опытов на яйцеклетках лягушки, аксоне кальмара, лимфоцитах человека, внутренней мембране митохондрий печени. В результате сделан обобщенный вывод, что мембрана живой клетки не содержат непрерывного диффузионного барьера в виде фосфолипидного бислоя, а содержит сеть полноразвернутых белков, поляризующих и структурирующих воду в многослойных образованиях, покрывающих клетку сплошным, непрерывным барьером. Функциональные группы белков, включая бета- и гамма - карбоксильные группы определяют адсорбционно-десорбционный характер диффузии веществ в клетку и из нее.
Таким образом, степень гидратации ионов будет зависеть от количественной и качественной их взаимосвязи с молекулами воды. Развиваемая по конфигурационным уровням энергия, будет формировать количественный состав частиц связанной фракции воды, чем определять степень гидратации живой протоплазмы. Большие популяции частиц в протоплазме, строящихся по закону геометрической прогрессии, могут функционировать под воздействием косвенного эффекта. При этом, как указывает Ling, структурная пертурбация свободных и связанных частиц может строиться не в конец в конец, как предполагает линейная модель, а перестраиваться по многоступенчатому зигзагообразному типу. В результате косвенный эффект даст возможность осуществить перегруппировку больших популяций частиц и тем самым установит фазовое относительное статическое состояние взаимодействующих молекул воды и ионов, способных аккумулировать энергию. В то же время огромные популяции свободных водных молекул и заряженных частиц будут совершать одновременное вращение и вибрацию под воздействием поступательной, вращательной и колебательной энтропии. Поскольку мы имеем дело со смешанной популяцией, представляющей более двух типов молекул, то сюда следует добавить еще и конфигурационный тип энтропии.
. Слабогидратированный слой, содержащий наибольшее количество подвижных гидратированных ионов, будет представлять смежную структурированную зону наиболее активного обмена частиц между свободной и связанной фракциями воды, характеризующейся большой энтропией. "Захват" очередной порции больших популяций частиц из свободной фракции воды в первую очередь будет осуществляться за счет энергии потребляемой из смежной слабогидратированной зоны. Общая плотность энергии связанной фракции воды в целом определит динамическое равновесие вновь образованной структуры, относительное энергетическое постоянство каждого фиксированного гидратированного иона.
Следовательно, сила индуктивных эффектов, развиваемая в ФЗС, позволяет создавать ближнюю и дальнюю упорядоченность взаимодействующих частиц, найти им определенное место, находиться в относительно статическом состоянии, поддерживать динамическое равновесие, в целом формировать гомеостатическую основу биологических структур. Связанная вода в клетке, содержащая мультислои, представленная как поляризованное, растворенное вещество, состоящее из водородных и ионных связей.
По современным понятием под состоянием твердого растворенного вещества следует подразумевать не ограничение передвижения молекул относительно друг друга, а образование правильной структуры кристаллической решетки, не разрушающейся под действием тепловых колебаний. В механизме гидратации и дегидратации живой ткани, следует отметить сложное комплексное взаимоотношение молекул воды, ионов и белка, сочетающие их химические, физические, биохимические и биофизические свойства. Поэтому проведение анализа через простую ассоциацию или сольватацию исследуемых частиц в растворе вызывает определенные трудности установления принципиальных различий между биологической жидкостью и обычной водой, выступающих в роли растворителя. Потребовались дополнительные углубленные теоретические и экспериментальные разработки ряда исследователей, позволяющих детально рассмотреть вопросы структурирования воды на биофизической основе, представленных двухфракционной моделью, применительно к живой протоплазме. Последовательные многолетние научные изыскания Ling в этом направлении, позволили ему детально разработать теорию ФЗСЛ и тем самым заложить фундаментальную основу механизмов функционирования заряженных частиц в протоплазме. Использование законов классической, квантовой и статистической механики делают возможным строго проследить за поведением частиц на определенных энергетических уровнях в связанных структурах воды, описать их взаимодействие с объемной водой.
При рассматрении вопроса электрических свойств живой протоплазмы отмечено, что сами протеины не обладают реактивностью[14]. Однако, находящиеся на поверхности молекул белка полярные группы и заряды, расположенные вдоль полипептидной цепочки, представляет определенное соотношение аминокислот, придает им функциональную способность. Ионо-водо-белковый комплекс молекулы, имеющий свободные карбоксильные группы, обладает свойством связывания катионов, где чередование пептидных связей с дипольными моментами при взаимодействии с дипольными зарядами молекул воды, служат матрицей для последующего многослойного структурирования воды. Управляющие лиганды изменяют электронную плотность в различных функциональных группах белка. Например, АТФ способствует присоединению ионов калия, что ведет к его депонированию в клетке, развертыванию полипептидных цепей белка. Это служит причиной дополнительного присоединения окружающих молекул воды, формирования водных коконов, слитие которых структурирует внутриклеточную воду. Расщепление АТФ, напротив, служит причиной освобождения пептидных связей от ионов калия и воды, замещения их ионами натрия. Такое циклическое изменение процессов может лежать в основе структурного функционирования клетки, определять величину свободной энергии, влиять на энтропию. Аминокислоты служат критерием специфичности различных протеинов. В геле указанные группы будут разобщены в альтернативе с NH- и CO – группами и станут NP-центрами, которые, притягивая молекулы воды, создадут регуляторные построения поляризованных множественных слоев в клетке.
На поверхности плазматических мембран мышечных и нервных клеток сайты имеют преимущественную анионную природу. Поверхностные анионные сайты определяют потенциал покоя и во времени не зависят от изменения внутриклеточной концентрации ионов, поскольку потеря 80-90% общего содержания калия в клетках мышцы лягушки в условиях эксперимента не изменяют его величины, хотя согласно мембранной теории, по мере потери калия изменения потенциала должны идти параллельно. Поэтому типичная клетка может поддерживать постоянство сложных функций, несмотря на весьма разнородные характеристики фиксированных ионных сайтов. Отмечается также свободное прохождение ионов водорода через клеточную мембрану. Находящиеся на поверхности мембраны потенциалы покоя существенно не изменяют ее проницаемость. Изменение концентрации внешних ионов может проводить к мгновенной перегруппировке ионного равновесия на поверхности мембран, с образованием нового стабильного потенциала покоя. Величина такого потенциала, связанная с концентрацией поверхностных фиксированных анионных зарядов, может удерживать определенное количество аккумулированных противоионов и не являться функцией внутриклеточной объемно-фазной концентрации калиевых ионов. Метаболический насос здесь не является необходимым. Ling oтмечает несостоятельность возникновения диффузионного потенциала, который в мышечных клетках лягушки "угасает", примерно, через 10 часов, при достижении нового равновесия, при блокировании всех известных метаболических процессов в клетке. При этом подчеркивается, что градиент установившегося потенциала покоя является четким и ограничен небольшой глубиной поверхности.
Наличие гидратации на протеинах в виде многослойной "водяной шубы" вокруг молекул белка и слитие образованных коконов, является фактором, определяющим гидратационные свойства внутренней структуры клетки. Реактивность протеинов может находиться в прямой зависимости от электрических свойств живой ткани, подверженной воздействию энергии электромагнитного поля (ЭМП), что делает необходимым акцентировать наше внимание на отдельных его свойствах в чисто биофизическом аспекте.
Теоретические и экспериментальные разработки, проведенные Ling G, нашли логическое подтверждение другого известного американского биолога Pollack G [15]. В частности, проведенная рентгеновская кристаллография показывает, что основным фактором, обеспечивающим распределение молекул между клеткой и средой, являются процессы адсорбции ионов или их исключение на поверхности белков цитоплазмы. Каркас геля протоплазмы, обозначенный плотным полимерным матриксом, имеет длинные полимерные нити и содержит сеть гидрофобных и гидрофильных участков, способных упорядоченно выстраивать множественные структурированные плотно упакованные водные слои за счет распределения зарядов и накопления внутренней энергии на поверхности. Трансформация геля обеспечивает фазовый переход, являющимся двигателем, приводящим в действие полимерный гель. Структурированная вода ведет к разворачиванию белков с помощью затраты энергии зарядов, скапливаемых на их поверхности и митоходриях, изменяет объемы, состав ионов, разделяет фазы. Адсорбция ионов калия в решетке структурированной воды в клетке более предпочтительная и прочная, чем ионов натрия. В результате не возникает необходимости затраты энергии для регуляции других ионов, их поддержания на определенном конфигурационном уровне.
2. Пондеромоторные (механические) силы ЭМП эукариотов, их влияние на функциональную способность
полипептидных цепей молекул белка
При рассмотрении энергии ЭМП клетки следует отметить, что сумма всех поляризованных "связанных” и свободных зарядов может быть сведена к механическим или пондеромоторным силам. Если условно представить неподвижные точечные заряды на бесконечно тонкой геометрической поверхности, то на единице ее площади можно "разместить" определенное количество зарядов, определяемых их плотностью, с образованием потенциального энергетического поля. Однако в реально существующем физическом поле устойчивое состояние атомов и молекул может поддерживаться только при наличии минимальной потенциальной энергии. Поскольку физические поля, содержащие заряды, отражают среднее значение их энергии и не обладают ее минимумом (теория Ирншоу), то статическое состояние такой системы невозможно.
Разрабатывая механическую теорию, Максвелл определяет действие пондеромоторных сил как натяжение деформированной материальной среды. При учете отсутствие эфира, И.Е.Тамм (1976)[16] предпринял попытку через математическую зависимость произвести замену пондеромоторных сил на эквивалентные им, действующие на натяжение поверхности объема, заключающего некоторую среду. При этом в первую очередь учитывались стрикционные силы, обусловленные диэлектрической постоянной, которые зависят от плотности диэлектрика, которые не были учтены Максвеллом. Объемное распределение “связанных” и свободных зарядов в такой системе будет конечным и непрерывным. Перемещение зарядов внутри объема может осуществляться за счет совершения определенной работы с затратой энергии со стороны внешнего поля. Пондеромоторная сила, действующая на каждый заряд в таком объеме, будет равна произведению сил поля Е на заряженное тело е:
F = Ee
Если отнести действие пондеромоторных сил на диполь, то направление его оси, стремящейся установиться параллельно воздействию поля, может зависеть от скорости изменения поля. Плотность пондеромоторных сил тогда всего диэлектрика будет соответствовать градиенту напряженности поля. Деформационная поляризация характеризуется смещением электронов с колебанием ядер и атомных групп. При деформации поля средние силы близкодействующих зарядов могут быть сведены к натяжению, а давление может рассматриваться как отрицательное натяжение. В условиях постоянного ЭМП установлено, что равнодействующая всех сил (F), воздействующая на все тела внутри объема (v), будет иметь выражение:
F = fdv, где f – объемная плотность тел, dv – элемент объема
Результирующая сила оказывает одинаковое действие на тела как внутри объема, так и на ее поверхности, уравновешивая равнодействующую силу, прилагаемую к объему извне. В результате получим объемную плотность энергии поля. Для неоднородного поля эта энергия будет определяться в точке [17]. Если учитывать отсутствие эфира, пондеромоторные силы будут воздействовать на заряды и несущие заряды тела (электроны, протоны и др.). Далее Е.И Тамм отмечает, что в переменном ЭМП нарушенное равновесие между пондеромоторными силами и электрическим натяжением будет проявляться избыточным натяжением поверхности объема и соответствующим изменением количества движения ЭМП в данном объеме. Также учитывается синхронное изменение напряженности магнитного поля и индукционная сила электрического поля, характеризующейся магнитным, механическим и спиновым моментами. Сведение этих сил к системе натяжения, определит их некоторый тензор. Стрикционное натяжение, выраженное в форме интеграла с локализацией энергии в определенном объеме, занимаемое телом, окруженным жидкостной средой, будет уравновешиваться гидростатическим давлением извне. Энергия здесь не имеет свойств аддитивности, поскольку возрастание напряженности поля в несколько раз приведет к соответствующему квадратичному увеличению энергии.
Тела, помещенные в ЭМП, испытывают пондеромоторные силы, выражающиеся давлением (отрицательным натяжением). На поверхности создается давление ЭМП, равное суммарной энергии падающей и отраженной электромагнитной волны. Эти закономерности должны учитываться в биологических системах, представляющих конструкции, где на разных организационных уровнях осуществляется гидравлический принцип наполненных жидкостью полостей окруженных мембранами [18].
Следовательно, поверхность натяжения ЭМП составит сумму "максвелловых" и стрикционных сил натяжения. Они будут соответствовать пондеромоторным силам, распространяющимся по объему без изменения их результирующей силы. Согласно теории Пойтинга, рассматриваемая в объеме энергия ЭМП может теряться, проходя через поверхность, в количестве на единицу энергии (эргов/сек). В ЭМП осуществляется перенос заряженных частиц, массы, импульсов, где электрокинетические явления возникают в результате разности потенциалов (электродиффузия) или разности градиента давления (бародиффузия), температуры. Это служит причиной необратимого движения потока зарядов, массы, теплоты. Обратный градиент таких величин ведет к уравновешиванию данной системы. В целом молекулярные, атомарные и ядерные системы, обладая дискретными свойствами, способны поглощать или отделять энергию определенными порциями. В таких системах законы движения квантовой механики могут быть перенесены и на классическую механику.
В основе изучения природы химической связи используются квантовые свойства электронов. Они же являются и связующим звеном между атомами и атомными группами в ЭМП, что позволяет производить расчет энергетических уровней любого химического элемента. Теория ковалентной связи допускает связь парой валентных электронов между двумя соседними атомами, определяемой октета правилом. Полярность атома приведет к смещению электрона в отрицательную или положительную сторону, а переход электронной пары к одному из атомов послужит причиной образования полной химической связи. В последнее время получила развитие концепция доминирующего переноса электронов через коллективные электронные возбуждения на значительные дистанции в белках, выступающих альтернативой химическим связям, ответственным за внутри белковый электронный транспорт, экспериментально подтвержденный на глобулинах [19]. Распределение электронов между функциональными группами с формированием длительно держащихся возбуждений (триплетов), является главным звеном в передаче энергии при фотосинтезе и биологических реакциях [20]. Реактивность триплетов зависит от состояния электромагнитных полей, приводящих к излучению избыточной энергии в виде протонов. Такая белково-водно-солевая система становится чрезвычайно мобильной и может быстро переходить из одного метастабильного состояния в другое, управляться гормонами, АТФ, лекарствами в относительно малых количествах. Эти данные, как и приведенные в разделах выше, указывают, что энергия ЭМП, переходя в пондеромоторную силу, может активно воздействовать на биологические структуры протеинов. Находящиеся на поверхности протеинов полярные группы и заряды, расположенные вдоль полипептидной цепочки, определят функциональную реактивность 23 аминокислот, которые составляют основу цикловых биохимических реакций.
Агрегация молекул белка при самосборке определяется его первичной структурой с подключением коротко- и дальнодействующих сил взаимодействия (водородных связей, дисперсионных, лондоновских сил и др.), а также специальных белков, способствующих сворачиванию полипептидных цепочек [21]. Внутренняя структура молекул белка определяется конформационным состоянием молекул воды и регуляцией метаболических процессов [22]. В разбавленных растворах макромолекулы разбухают и принимают форму "статического клубка", содержащие неперекрещивающиеся координационные сферы. Высококонцентрированные растворы полимеров имеют двухфазную систему и содержат перекрещивающиеся координационные сферы, где каждая фаза характеризуется определенной молекулярной массой. В результате свободный объем при образовании раствора увеличивается для полимера и уменьшается для растворителя при нарастании энтропии.
Первичная структура полимера представляет связанный остов полипептидной цепи, содержащий аминокислотную последовательность ста и более ковалентною связанных аминокислотных остатков. В основе ковалентной связи находятся электронные оболочки водорода, кислорода, азота и углерода, которые легко образуют восстановленные гидратированные формы органических соединений. При этом образование водородных соединений значительно превосходит скорость ковалентных связей. Полипептидная связь представляет ковалентные соединения аминокислотных остатков, составляющих основу белкой молекулы. Полипептидная цепь содержит заряженные гидрофобные R-группы, которые повышают упорядоченность в окружении молекул воды, образуют максимум водородных связей друг с другом. В результате на поверхности белковой молекулы сосредоточены заряженные группы, а гидрофобные "спрятаны" внутри молекулы. Это ведет к возрастанию степени упорядоченности и снижению энтропии, тогда как водное окружение вокруг полипептидной цепи стремится к максимальной энтропии. В результате образуется трехмерная упорядоченность полипептидных цепей, наделенная биологической активностью [23].
Глобулярные белки содержат 20 аминокислот и 8 нуклеотидов, сочетающихся в различной последовательности. Вторичная и третичная структура полипептидной цепи образует соответственно спиралевидную, пространственную ее укладку и представлена конформацией глобулярного белка. Содержание двух и более таких полипептидных цепей в структуре белка, названных олигомерами, свидетельствуют о четвертичной их структуре. В результате глобулярные белки (альбумины, гемоглобин и др.), выполняя транспортную функцию, имеют плотноупакованную трехмерную конформационную структуру, содержат от 100 до 300 аминокислотных остатков, не имеющих замкнутых полипептидных цепей. Самопроизвольное развертывание (денатурация) и свертывание (ренатурация) белков происходит без нарушения ковалентной связи между аминокислотными остатками. Путем ферментативного гидролиза длинные полипептидные цепочки в определенных участках делится на короткие цепочки, которые в последующем могут вступать в биохимические цикловые процессы. После ферментативного разъединения, проводится самосборка оставшихся участков полипептидных цепей. Ферменты "различают" отдельные участки полипептидной цепи по знаку электрических зарядов, определяя точное расстояние до их расположения. Приобретая такую пространственную конфигурацию, полипептидная цепь становится функционально активной, а участие ферментов и гормонов обеспечивает ускорение биохимических реакций.
Ансамбль ферментов в такой структуре может в любом месте осуществлять разрыв и образовать новую пептидную связь. Углеродные скелеты аминокислот, подвергшиеся окислительному расщеплению на фрагменты, включаются в цикл трикарбоновых кислот. Множественные ферментные системы могут взаимодействовать с мембранами, рибосомами, митохондриями и др. Скорость течения в них реакций автоматически соответствует скорости процессов, характерных для всей системы [24]. Эффективность работы ферментов подчиняется уравнению Михаэлиса Мейтн, где с увеличением концентрации субстрата уменьшается прирост скорости реакции [25].
С.И. Аксенов и соавт., [22] считают, что стабилизация биологических процессов внутри молекулы белка может достигаться только за счет сил Ван-дер-Ваальса и гидрофобного взаимодействия функциональных систем, поскольку, по их мнению, отсутствует прямая регуляция дальнодействующими электростатическими силами. При этом наличие незначительного количества связанной воды внутри макромолекул белка при тепловом эффекте делает чувствительной и подвижной их конформационную структуру под влиянием направленного действия водородных связей. На основе методов водородного обмена и протеолитической дегидратации предполагается, что внутренняя структура глобулы обладает высокой флуктуационной подвижностью [26].
Таким образом, пондеромоторные и стрикционные силы, осуществляя натяжение поверхности объема ЭМП клетки, активно воздействуют на ее внутреннюю структуру, буквально “пропитывают“ возрастающей энергией всю глубинную атомарную и молекулярную биологическую структуру живой протоплазмы клеток. Данные процессы могут являться основными в регуляции энергии молекул воды, белка и ионов по оказанию прямого нелинейного воздействия квантов и их излучения на поток протонов, гидратацию и метаболизм в эукариотах.
3. Функция цикловых биохимических процессов в эукариотах
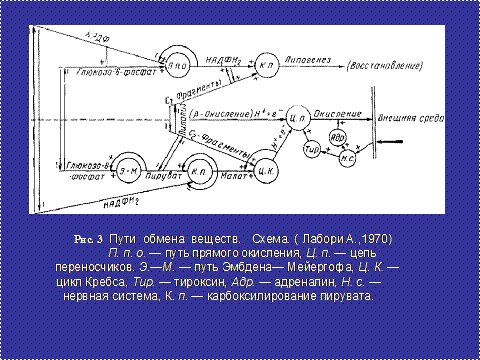
В настоящее время накоплено достаточное количество сведений об энергетических биохимических процессах, происходящих в клетке. А.Лабори (1970)[27] энергетический обмен сводит к двум процессам: циклу Эмбдена-Мейергофа-Кребса и прямому окислению глюкозы - пентозному циклу Варбурга-Дикенса-Липмана (рис 3).
|
|
Поэтапное течение процессов определяется исходным количеством субстрата глюкозо-6-фосфата, находящегося в восстановленном или окисленном состоянии. В цитоплазме митохондрии считаются основными энергетическими преобразователями белка и липидов. Митохондрии, как правило, концентрируются в зонах наиболее нуждающихся в энергии АТФ. Наружная мембрана митохондрий, имеющая ситеобразное строение, проницаема для небольших молекул цитозоля. Внутренняя же мембрана малопроницаема и на ее большой поверхности происходит окисление молекулярным кислородом глюкозы и жирных кислот до СО2 и Н2О. Ферменты, находящиеся на внутренней мембране, позволяют с большим эффектом катализировать реакции. При окислении атомарным кислородом одной молекулы глюкозы освобождается энергия, способная образовать 36 молекул АТФ, тогда как при анаэробном окислении в цитозоле освобождается только две молекулы АТФ различных метаболических субстратов, где глюкозе принадлежит особое место. Глюкоза наделана высокой организацией и большой потенциальной энергией. Глюкоза, как правило, переносится путем облегченной диффузии, но может переноситься и высокогидрофильными мембранными белками. Функционирование пути Эмбдена-Мейергофа-Кребса в целом зависит от отношения НАДН2/НАД и АТФ/АДФ, Р. Этот путь считается основным для всех живых клеток.
Прямой путь аэробного окисления, известный как пентозный цикл в цитоплазме протекает через окисление глюкозы. Глюкозо-6-фосфат способствует синтезу нуклеиновых кислот и восстановлению запасов молекул водорода, которые вступают в связь с НАДФ и вторично утилизируется для гидроксилирования или липогенеза. С помощью системы НАД (НАДФ) происходит накопление молекул водорода (НАДН2), превращение их в атомы водорода. В процессе дегидрогенации в цикле Кребса образуется пять пар атомов водорода. На внутренней мембране митохондрий содержится большое количество белка и липидов, поступающих на непрямой путь окисления. Электроны включаются в дыхательную цепь, где большая часть их энергии тратится на прохождение потока протонов в направлении из матрикса в межмембранное пространство и далее за пределы митохондрий в окружающую водную среду [28].
Непрямой путь окисления ответственен за расщепление водородных атомов на электроны и протоны. Последние поступают в окружающую водную среду, а электроны в дыхательную цепь. В этих циклах ферменты способствуют процессу окислительного фосфорилирования, дающую большую часть АТФ. Гидролиз АТФ в цитоплазме освобождает АДФ. В матриксе АДФ восстанавливается в АТФ. Это позволяет создать большую концентрацию АТФ и использовать его энергию для внутренних запросов клетки. Энергия, вырабатываемая за счет АТФ и креатинфосфата, полностью обеспечивает биологические функции клетки [29].
Мононуклеотиды принимают активное участие в реакциях, как простого обмена, так и энергетического обмена. В результате синтеза жирных кислот может частично образовываться до 50% НАДН2, который служит источником водорода. Запасы НАДН2 восполняются за счет восстановленных форм НАД (НАДН2). Жиры через В-окисление в цикле Кребса служат активным источником пополнения электронов и ионов водорода, доставляемых к кислороду. Эти процессы также сопровождаются фосфорилированием и окислением с образованием трех молекул АТФ и 117 фосфатных связей, богатых энергией [30]. Существует также механизм регуляции с обратной связью: рост метаболизма побуждает к интенсивному синтезу АТФ за счет окислительного фосфорилирования. Окисление НАДН2 направляет глюкозо-6-фосфат по пентозному тути и восстанавливает НАДФ. При определенной концентрации НАДФ не исключается течение пентозного обмена. Однако пентофосфатный путь не является главным путем окисления глюкозы.
Гормоны - продукты эндокринных желез, выступая медиаторами стимула и ингибирования метаболических процессов в тканях и органах, ускоряют или замедляют выработку молекул, атомов, ионов водорода, электронов и протонов. Путь Эмбдена - Мейергофа - Кребса возбуждается катехоламинами, которые, в конечном счете, ведут к мощному выбросу ионов водорода из этой системы. Найдена тесная взаимосвязь между содержанием ацетилхолина и освобождением катехоламинов. Эффективность катехоламинов проявляется фосфорилазной активностью за счет способности соединяться с АТФ внутри специфических гранул под воздействием нервных импульсов. Низкие значения рН внутри и вне клетки, при выраженной способности буферной системы протоплазмы и белков, в течение длителного времени через цепь переносчиков поддерживается неизменной активность ионов водорода, электронов, протонов, прежде чем они вступят в соединение с кислородом [31].
Указанные циклические метаболические процессы в клетке одинаково интенсивно протекают как в цитоплазме, так и непосредственно в недрах клеточного ядра. АТФ является основным источником энергии при метаболизме. Однако установлено, что потребность в энергии АТФ клеткой в 30 раз больше, чем она способна производить[11].
Таким образом, в компартментах клетки функционирует два основных цикла - Эмбдена-Мейергофа-Кребса и Варбурга-Дикенса-Липмана, эволюционно являющиеся наиболее консервативными, а потому и наиболее значимыми в метаболизме белков, жиров и углеводов, которые направлены на образование ионов водорода. В процессе дегидрогенации (цикл Кребса) молекулы водорода распадаются на атомы водорода, являющихся источником ионов водорода, электронов, протонов. Электроны, в свою очередь, находясь в возбужденном состоянии, поэтапно отдают энергию в дыхательной цепи, способствуют прохождению протонов из матрикса, а также восстановлению АТФ через соединение АДФ и неорганический фосфор.
4. Функция слабых и сверхслабых полей в эукариотах
До середины ХХ столетия биологи придерживались взглядов, что цитоплазма представляет разбавленный солевой раствор, имеющий элементы связанной воды и макромолекулярной субстанции. Это положение экспериментально подтверждалось незамерзающими свойствами клеточной воды при – 20 оС, практической нерастворимостью связанной ее фазы [32], присутствием малого количества такой структуры в клетке [33]. Свободное движение воды в клетке ограничено за счет избранного включения через водородную связь ее молекул карбоксильными и амидными группами протеинов с образованием сайтов. Последние могут быть также представлены сорбцией полярных и пептидных цепочек [34] и составлять первичные места гидратации на глобулярных и фиброзных протеинах [35]. Гидратация первого слоя воды, создаваемая дисперсионной энергией Ван-дер-Ваальса, представляет полярную поверхность, на которой осуществляется агрегация соседних полярных групп и образуются последующие мультислои с неустойчивой структурой. Было также обращено внимание на тот факт, что в клетке растворенные вещества могут вступать в метаболизм полностью или ограниченно, поддерживая пониженную концентрацию веществ (сахарозы, галактозы), чем отличает их от концентрации в растворах, окружающих клетку [36].
На многочисленных Сольвеевских конгрессах в Брюсселе берет начало общенаучная идея слабых воздействий, а все углубляющееся эволюция знаний элементарных частиц порождает квантовую механику в микромире. Квантовая механика описывает “облако вероятностных электронов”, где громадное количество биохимических изменений может происходить в пределах этих образований. Биологи вводят понятия о молекулах и агрегатах как о структурных единицах, окруженных водой, являющихся неотъемлемой частью живой материи. Такие виды протоплазматических структур уже позволяют иметь представление о различных видах электронных возбуждений и передаче энергии на расстояния. Электрон и некоторые ядра (Н, Р, Сl) обладают дополнительными свойствами – магнитным моментом. В трудах брюссельской школы, ее основателя - И.Р.Пригожина, последние десятилетия проводится активная разработка теории неклассической термодинамики в физических и биологических системах, базируемая на открытии неравновесных структур и нестабильных систем, слабых нелинейных воздействий далеких от термодинамического равновесия [37].
В любой молекуле имеются свои малые естественные или индуцированные магнитные поля и эти поля слегка различны для магнитных ядер, входящих в состав разных химических групп. Существует гипотеза, что ион с данным знаком окружен ионами с противоположным знаком. Между ионами имеет место электростатическое взаимодействие, где уровень энергии должен подниматься с увеличением заряда иона и с увеличением концентрации соли. При этом энергия активации, возбуждения, ионизации находятся в пределах единиц Эв или долей Эв, что существенно превышает величину kT, равную около 0,02 эВ. Слабые и сверхслабые воздействия, как правило, меньше величины kT, в биологии не используются. Однако квантовый подход и нелинейный анализ мышления вносит существенный вклад в исследование таких пределов в живые биологические системы [38].
В частности, уже разработана биологическая наноразмерная система, представляющая совокупное действие молекулярных ячеек, содержащих хотя бы по два биополимера, разделенных водой и объединенных каркасом, окруженных неоднородной связанной водой и обладающей эффектом спинового эха. Возникающая любая локальная деформация вдоль цепочки макромолекулы ведет к образованию энергии в виде солитона, который может рассеиваться как поляризационная волна в окружающее пространство, представлять дальнодействующую межмолекулярную миграцию энергии и поддерживать структурную организацию поляризованной воды, окружающей макромолекулу. Представленная новая модель способна усиливать слабые и сверхслабые воздействия за счет внесения вклада электромагнитных, гравитационных, акустических полей, чем обеспечивать существенный подъем общей энергии в биологических системах [39].
"Слабые поля" в биосистемах, создаваемые подвижными ионами, характеризуются постоянной, переменной и комбинированной величиной магнитной индукции, генерируют биоэлектрические потенциалы [40,41], и сравниваются с магнитным полем Земли равным около 5О мкТл [42]. Микроимпульсы таких полей, составляющие 0,01-1 мкТл при частоте от 0 до 25 Гц, управляются химической активностью, поддерживают реакции конденсации аминокислот, регулируют гомеостаз биосистем [43]. Кроме того, на клетку воздействуют гравитационные, акустические, тепловые и другие виды проникающих полей, имеющих различную интенсивность, частоту, периодичность, которые приводят к изменению гомеостатических реакций. Интенсивность же собственных полей излучения клетки определяет ее генетический код и значительно ниже окружающего магнитного фона [44]. Эффект внешнего электромагнитного излучения зависит от чувствительности биообъекта, находящий как его непосредственный отклик, так и через определенный промежуток времени, вызывая активизацию биологических процессов [45].
С квантовомеханических позиций показано влияние внешнего поля на спиновую релаксацию при биохимической реакции синтеза АТФ, что, в общем, не исключает наличия низкоэнергетической синхронизации, и управления спиновым состоянием живых клеток за счет внешнего магнитного поля Земли [46]. Физические факторы низкой интенсивности при слабом и сверхслабом воздействии на структуру воды выявляют у нее ряд особенностей. За счет спин-изомеров у пара-Н2О, у которых отсутствует движение, водородные связи образуют льдоподобные структуры, тогда как юлообразное вращение у орто-Н2О с участием электростатических сил, служит причиной развития разной степени их адсорбции на поверхности. Химические и биохимические реакции протекают с условием совпадения углового момента реагентов и преодоления их энергетического барьера, что существенным образом отражается на спиновом моменте электронов и ядер. Исключение могут составлять только ядра водорода, которые свободно проходят под барьером без энергетической накачки. Управляя спиновым состоянием таких реагирующих частиц, можно изменять временной масштаб химических реакций, и через низкоэнергетический механизм воздействовать на скорость их течения такими низкоэнергетическими факторами воздействия как ЭМП низкой интенсивности, относящихся к области спиновой химии [47].
Сравнение высоких движений протонов в боковых группах белка со скоростью движения самих молекул белка позволяет более чем в 10 раз увеличить количество содержания связанной воды. Однако отмечается затруднение в определении обмена между связанной и объемной водой из-за межемкостных лигандных отношений. Продолжительность жизни водных молекул на поверхности селиконового геля составляет 3 х 10-3 с., что позволило развить стохастическую теорию спиновой системы, которая предполагает наличие двух адсорбционных фаз молекул воды. Каждая фаза характеризуется единственным релаксационным временем. ЯМР-измерение позволяет довольно точно судить о связанном состоянии водных молекул около твердых поверхностей и свободном растворе по модели быстрой протонной диффузии [48].
Следовательно, в свободной и связанной жидкости состояние энергии спиновой системы ядер водорода может контролироваться через ЯМР-измерение. Величины времени Т1 и Т2 исследуют влияние напряженности окружающих переменных полей на заселенность возбужденных спинов по различным энергетическим уровням, зависящих от скорости движения протонов, их плотности, поступательных и ротационных свойств. Так увеличение скорости потока подвижных протонов ведет к резкому повышению чувствительности спиновой системы. Эффекты снижения коэффициента самодиффузии воды и времени релаксации ядер водорода объясняются также за счет “эффекта обструкции”, прямой гидратации и увеличения корреляционного времени части молекул воды.
В растворе белка имеет место снижение времени релаксации ядер водорода воды и величины коэффициента самодиффузии молекул воды. Выявленный феномен объясняется поглощением энергии при вращении эллипсоидальных молекул белка, диффузии мобильных протонов, ускорением подвижности молекул протеина, имеющих малый молекулярный вес. Величина исследуемых параметров также зависит от концентрации глобулярных белков, конформационной мобильности молекул воды внутри глобулы, адсорбции воды на поверхности белка. Воздействие низкоэнергетических эффектов выявляют ряд особенностей структуры пара-Н2О и орто-Н2О, где должны быть созданы условия поддержания спиновой системы реагентов при участии фонового кислорода и реализации химических и биохимических реакций по преодолению энергетического барьера и соблюдения запрета углового момента. В то же время отсутствует определенность суждения о функционировании молекул воды и белка в бесконечном пространстве или на твердой поверхности, позволяющей раскрыть исследуемый феномен.
Заключение
Таким образом, теоретические и экспериментальные исследования, проведенные G. Ling (1962, 2008), А.Лабори (1970), И.Е. Таммом (1976), Н.Б.Джаксон (2009), Dg. Pollack (2001), и рядом других авторов, позволяют прийти к заключению, что биологическая жидкость внутри клеток, содержащая белки, ионы, наделенная биофизическими свойствами, существенно отличающихся от обычной воды. Связанная вода, согласно двухфракционной модели, включает относительно устойчивую структуру гидратированных слоев, в которых с помощью сил коротко- и дальнодействия в наибольшей степени обеспечивается стабилизация молекул воды, ионов и других частиц. В фиксировано-зарядной системе, представлены относительно фиксированные заряды, способные избирательно сорбировать ионы калия в присутствии натрия в протоплазме, что исключают необходимость функции натриевого насоса, траты на него энергии АТФ. ТФЗЛ отражает единую физико-химическую теорию жизни, где теория ассоциации-индукции анализирует взаимосвязь ионов и молекул воды, направленных на развитие потенциальной энергии живой протоплазмы, способной значительно превосходить энергию АТФ. ФЗС по Ling позволяет наиболее объективно обосновать функцию связанной фракции воды.
А.Лабори энергетический обмен сводит к двум процессам: циклу Эмбдена-Мейергофа-Кребса и прямому окислению глюкозы - пентозному циклу Варбурга-Дикенса-Липмана, поэтапное течение которых определяется исходным количеством субстрата глюкозо-6-фосфата, находящегося в восстановленном или окисленном состоянии. Данные процессы наиболее значимые в метаболизме белков, жиров, углеводов и направлены на образование молекул водорода. В процессе дегидрогенации (цикл Кребса) молекулы водорода распадаются на атомы водорода, являющихся источником ионов водорода и электронов. Электроны, в свою очередь, находясь в возбужденном состоянии, поэтапно отдают энергию в дыхательной цепи, способствуют движению протонов, а также восстановлению АТФ через соединение АДФ и неорганический фосфор.
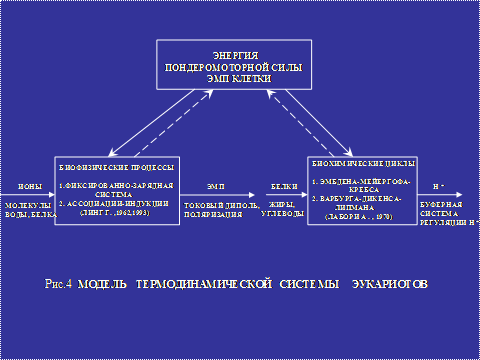
Разработанная нами модель, представляет условный аналог совокупности неделимых элементов, отражающих нелинейную реализацию биофизических и биохимических процессов, основанных на законах неклассической термодинамики неравновесных процессов открытой системы живых систем. Общие законы неклассической термодинамики направлены на изучение взаимодействия энергии молекул воды, ионов и белка многослойной поляризованной структуры, разработку общих закономерностей превращения потенциальной энергии, ее реализации через свободную энергию в сторону уменьшения и возрастания энтропии. Основные процессы метаболизма в биохимических циклах преследуют конечную цель - выработку ионов водорода, расщепление их на электроны и протоны. В качестве же главного координирующего звена неделимых элементов выступает энергия пондоромоторных и стрикционных сил ЭМП клетки, осуществляющая управляемую регуляцию биофизических и биохимических процессов в протоплазме, что отражено на представленной камерной модели термодинамической системы эукариотов (рис.4).
Метод термодинамики потенциалов рассматривает сигналы входа в камерную систему биофизических процессов – ионы, молекулы воды и белка, выхода – ЭМП, где его основу составляют токовый диполь и поляризация движущихся частиц. Молекулярно-конетический метод позволяет внутри системы проследить за поведением фиксированных частиц в гидратированном слое, распределяемых по энергетическим уровням в протоплазме. Энергия прямого, свободного и индуктивного эффектов определяет стабилизирующую силу, активно влияющую на распределение гидратированных ионов. Количественный состав свободных и связанных заряженных частиц по энергетическим уровням формируется за счет энергии косвенного эффекта, работающего по принципу “все или ничего”, что делает возможным проводить периодическую перегруппировку больших популяций частиц по закону геометрической прогрессии. Распределение внутренней энергии между хорошогидратированными, средне- и слабогидратированными слоями, относительно быстрая перегруппировка больших популяций и передвижение заряженных частиц между энергетическими уровнями, наделяет поляризованные связанные слои воды свойством мобильности, способными быстро перестраиваться на внешние и внутренние запросы живой протоплазмы. Такая закономерность распределения частиц будет определять уровень насыщения водой и ионами всей связанной фракции воды, учитывать ее внутреннею потребность в энергии, закладывает основу раскрытия механизма гидратации живой ткани, интенсивности движения водных потоков исследуемой биологической структуры.
|
|
Метод термодинамики потенциалов биохимических процессов направлен на анализ в обособленной открытой камере сигналов входа, которыми являются молекулы белка, жиры и углеводы, а сигналами выхода – молекулы, атомы, ионы водорода, расщепляющиеся на протоны и электроны. Молекулярно-кинетический метод на основе фундаментальных работ А.Лабори позволяет внутри клетки анализировать энергетический обмен при метаболизме В процессе дегидрогенации (цикл Кребса) молекулы водорода распадаются на атомы водорода, являющиеся источником ионов водорода, электронов и протонов. Движущийся поток протонов в поляризванной структуре приобретают подъем энергии на необычайно высокий уровень.
Современные методы ЯМР подтверждают наличие двухфракционного структурирования воды на твердой поверхности с характерным временем релаксации протонов воды для связанной и свободой фракции. Снижение времени релаксации протонов воды в белковых водно-солевых растворах объясняется за счет диэлектрического поглощения эллипсоидальными молекулами белка, потоком мобильных протонов при наличии возрастающей их чувствительности, скорости, плотности, а также поступательных и ротационных свойств. Метаболизм, подключенный через общую неспецифическую реакцию стресса, явится первичным звеном, отвечающим на воздействие экстремального фактора и не зависящим от характера его происхождения (химического, механического, термического и др.). Эти процессы проявляются различной степенью интенсивности биохимических цикловых реакций. Выброс дополнительного количества протонов из метаболических цикловых реакций изменит силу потока мощности протонов, усилит отрицательное натяжение (давление) объема ЭМП клетки на ее биологические структуры. Передача кинетической энергии окружающим молекулам воды от протонов неоднозначно увеличит скорость движения водных потоков в связанной фракции воды (быстрого, замедленного и медленного) с находящимися в них частицами, отвечающим энергетическим уровням двухфракционной модели воды клетки
Биофизические и биохимические процессы, объединенные взаимодействием, могут контролироваться величиной пондеромоторных сил через степень натяжения поверхности объема ЭМП клетки и определять величину плотности энергии его объема, оказывающей активное воздействие на скорость метаболизма, протекающих в биологических структурах протоплазмы, интенсивность движения водных потоков в клетке. Выдвигаемая концепция позволяет также рассматривать биофизическую и биохимическую взаимосвязь не только через призму квантовых свойств электронов, но и в альтернативе коллективных электронных возбуждений вокруг молекул белка, взаимодействия ионов и молекул воды, потока протонов гидратированной фазы под воздействием ЭМП клетки.
A MODEL OF THE INTERACTION ENERGY BETWEEN WATER MOLECULES, IONS AND PROTEIN OF THE POLARIZED MULTILAYER STRUCTURE OF EUKARYOTES
V.V. Vapnyar
Federal State Budget Institution "Medical Radiological Research Center” of the RF
Health and Social Development Ministry, Obninsk, Russia, vap@obninsk.com
Литература
1. Eisenman G., Rudin D.O., Casby J.U. //Science. 1937. V.126, N3277. P.831-834
2. Jenny H. //J. Phys. Clum.-1932.V. 36. N8. P. 2217-2258
3. Latimer W.M., Pitzer K.S., Slansky C.M. // J.Chem. Phys. 1939 V. 7. P.108
4. Кнеппо П., Титомир Л.И. Биомагнитные измерения. М: Энергоатомиздат,1989. 285с
5. Введенский В.Л., Ожихин В.И. Сверхчувствительная магнитометрия биомагнетизм. М.:Наука, 1986. 200 с.
6. Fromherz P. // Eur.Bio-Phys.J. 1997. V.26. N1. P.56
7. Garlid K.D. //In: N.Drost-Hansen and Is Clegg (eds) Cell-associated water, Acad.Press Inc., New York, 1976.P.293-362
8. Fullerton G.D., Potter J.L., Dornbluth N.G. // Magn. Reson. Imag. 1982. V.2.P.209-228
9. Jacobson B. // J.Amer.Chem.Soc. 1955. V.77. P.2919-2926
10. Bernal J.D., Fowler R.H. // J.Chem.Phys. 1933. V.1. P.515-548
11. Ling G.N. A physical theory of the living state: the association-induction hypothesis //New York-London, 1962.553P.
12. Линг Г. Физическая теория живой клетки. Незамеченная революция. С-Петербург:Наука,2008.375 с.
13. Ketelaar J.A.A.// Chemical Constitution: An Intraduction to the Theory of Chemical Bond (transl. By L.G.Jackson),
Elsevier Amsterdam and New York, 1953
14. Ling G.N. 1993 Physiol. Chem. Phys.& Med. NMR 25:145
15. Pollaсk G.H. Cells, Gels end the Engines of Life; A New, Unifying Approach to Cell Fungtion (Ebner.& Sons,
Seattle, WA, 2001)
16. Тамм И.Е. Основы теории электричества. - М.: Наука. - 1976. - 616 с
17. Ремизов А.Н. Медицинская и биологическая физика: Учебник для вузов // Изд. 3-е исправленное.- М; Высшая школа,1999.- 616 с
18. Gufmann W.F. Organismus und Energie. // Aufzafze und Reder Senckenberg naturforsch Ges. 1992. N38. P.9 – 25
19. Лахно В.Д., Трансляционная инвариантность и проблема биполярона. 1998 УФН.168(4):465-469
20. Szent-Gyorgyi A. Bioenergetics. //Acad. Press inc. New York. 1957, 143 Р
21. Поглазов Б.Ф. // Биохимия,1996, Т.61, Вып.11. С.1941 – 1947
22. Аксенов С.И., Боженко В.К., Калачихина О.Д. // Биофизика. 1990. Т.35. С.39-45
23. Джаксон М.Б. Молекулярная и клеточная биофизика. М.: Мир; БИНОМ. Лаборатория знаний,2009. 551с
24. Ленинджер А. Биохимия - М: "Мир", 1976. 957 с
25. Хочачка П., Дж. Сомеро // Биохимическая адаптация М:"Мир". 1988. 567с
26. Абатуров Л.Б., Лебедев Ю.О., Носова Н.Г. // Молекулярная биология, 1983. Т.17. Вып.3.С. 543-567
27. Лабори А. Регуляция обменных процессов. M: Медицина, 1970. 384 с
28. Mitchell A.M.J. //Phillips Brit.J. Appl. Phys. 1956. V.7.N1. P.67-72
29. Aльбертс Б., Брей Д., Льюис Дж. и соавт. Молякулярная биология клетки. М.:Мир.1986-1987.т.1. 521с
30. Иванов И.И. Введение в клиническую биохимию Л.: Медицина.1969.494 с
31. Костюк П.Г., Сорокина З.А., (1960) (в Кн.: Membrane transport and metabolism. Proc. of a Symp. Held in Prague,
193, Acad. Press, London-N,Y.,1960-1961).
32. Rubner M. //Abhandl, Preuss, Acad. Wiss, Phys, Math, KL, I 1 (1922)
33. Hill A.V., // Proc. Roy.Soc.(London) Ser.B,106,477 (1930)
34. Pauling L. // J. Amer.Chem.Soc., 67, 555 (1947)
35. Fisher H.F. // Biochem.Biophys. Acta 109, 544 (1965)
36. Troschin, A.S. Das Problem der Zellermeabilitat, Fischer, Jena, 1958
37. Пригожин И. Определено ли будущее? Москва-Ижевск,2005. 240с
38. Галль Л.Н., Галль Н.Р. //Биофизика, 2009.т.54,вып.3.С.563-574
39. Галль Л. В мире сверхслабых. Нелинейная квантовая биоэнергетика: новый взгляд на природу жизни.
С-Петербург,2009, 317с
40. Окритов В.А. // Cорос. образ. ж.- 1996. - N9.- С. 40 – 46
41. Чукова Ю.П. Эффекты слабых воздействий. М.: Компания “Алес“, 2002.426с
42. Леднев В.В. // Биофизика, 1996, Т.41. Вып.1. С.224-231
43. Новиков, А.С.Лисицын // Биофизика 1997. Т.42. Bып.5. С.1003 – 1007
44. Будаговский А.В. //Тр. конф, "Электромагнитные излучения в биологии. (БИО-ЭМИ-2000)". Калуга,2000.
С.27-31
45. Кузьмичев В.Е., Чернова Г.В. // Тр. Конф. "Электромагнитные излучения в биологии (БИО-ЭМИ-2000)",
Калуга, 2000, С.111-113
46. Бучаченко А.Л. Новая изотопия в химии и биохимии.//М.,Наука,2007
47. Дроздов А.В. //V Международный конгресс. Слабые и сверхслабые поля и излучения в биологии и медицине. Сб. избранных трудов. С-Петербург,2009. С.162-169
48. Zimmerman J.R., Brittin W.E. // J.Phys.Chem. 1957. V. 61. P. 1328-1333