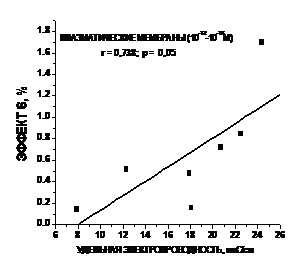Адрес этой статьи в интернете: www.biophys.ru/archive/congress2012/proc-p84-d.htm
МЕХАНИЗМ ДЕЙСТВИЯ СИНТЕТИЧЕСКОГО АНТИОКСИДАНТА ФЕНОЗАНА КАЛИЯ В СВЕРХНИЗКИХ КОНЦЕНТРАЦИЯХ НА Поверхностные ОБЛАСТИ ЛИПИДОВ ПЛАЗМАТИЧЕСКИХ МЕМБРАН.
Пальмина Н.П., Часовская Т.Е., Бинюков В.И., Плащина И.Г.
Федеральное государственное бюджетное учреждение науки Институт биохимической физики имени Н.М. Эмануэля РАН,
119334, Россия, Москва, ул. Косыгина 4, E-mail: npalm@sky.chph.ras.ru
Действие биологически активных веществ (БАВ) в сверхмалых дозах (СМД) на биологические мембраны является одним из наиболее удивительных открытий двух последних десятилетий. Данный эффект установлен для веществ самой различной химической природы и биологических механизмов действия: антиоксидантов, противоопухолевых агентов, радиопротекторов, ингибиторов и стимуляторов роста растений; нейротропных веществ различных классов, гормонов, адаптогенов, иммуномодуляторов, пептидов, детоксикантов и т.д. В настоящее время обнаружено более 100 веществ, обладающих этим свойством. Весьма различны и уровни биологической организации, на которых зафиксирован эффект СМД – от макромолекул, клеток, органов и тканей до животных, организма человека и популяций [1-4].
Однако, несмотря на большое количество работ по данной тематике, механизм действия БАВ в СМД по- прежнему до конца не установлен. Анализ накопленных данных позволил выявить ряд общих закономерностей, характерных для всех БАВ, проявляющих активность в СМД на разнообразных биологических системах, наиболее важной из которых является нелинейная зависимость эффекта от концентрации БАВ [1,4].
Природа аналогии этих закономерностей может быть связана с общностью критических мишеней. На основании ряда работ [5-9] можно полагать, что в качестве таких мишеней могут выступать клеточные и субклеточные мембраны. Именно в биологических мембранах локализованы важнейшие регуляторные системы, отвечающие за функционирование клетки и организма: системы вторичных посредников и пероксидного окисления липидов (ПОЛ) [10-14], которые находятся в тесном взаимодействии и оказывают влияние друг на друга [12,13,15].
На основании подробных исследований на различных биологических мембранах было зафиксировано влияние СМД таких БАВ, как природный антиоксидант α-токоферол, пептид тиролиберин и форболовые эфиры, на основные параметры системы ПОЛ (структура мембран, продукты окисления) [6, 16-18], активность ключевых ферментов регуляторных систем, сосредоточенных в мембранах [19-21], и сделаны определённые заключения о механизмах действия этих агентов в СМД [16, 22-25]. Все эти вещества природного происхождения, поэтому возникает вопрос о том, насколько выводы, сделанные для природных БАВ, справедливы для синтетических агентов.
В ряде работ установлена способность синтетического антиоксиданта фенозана калия (ФК) проявлять эффект в СМД [26-28], однако детальных исследований в достаточно широком интервале концентраций, что является необходимым для получения строгой дозовой зависимости и каких-либо заключений о его механизме его действия, не проводилось.
Регуляторные системы клетки, о которых речь шла выше, локализованы в плазматической мембране, взаимодействие между ними, так называемые «переговоры», весьма существенны как для функционирования клеток, так и для работы отдельных звеньев этих регуляторных систем. ФК, являясь синтетическим антиоксидантом, с одной стороны, безусловно, может влиять на систему ПОЛ; с другой стороны, известно, что он способен, в том числе и в СМД, изменять активность ключевого фермента фосфоинозитидного цикла – протеинкиназы С [29]. Поэтому с нашей точки зрения для выяснения механизма действия ФК в СМД целесообразно изучение влияния ФК именно на ПМ. Так как одним из важнейших звеньев регуляторной системы ПОЛ является структура липидной компоненты мембраны, цель данной работы заключалась в выяснении закономерностей влияния ФК в широком интервале концентраций (10-5-10-21 М) на структуру поверхностных липидных регионов плазматических мембран (ПМ) клеток печени in vitro, а также липосом, приготовленных из липидов, экстрагированных из ПМ.
МЕТОДЫ ИССЛЕДОВАНИЯ.
Водные растворы ФК в диапазоне концентраций 10-5-10-21 М были получены методом последовательного разведения на порядок исходного 10-5 М раствора дистиллированной водой. Полученный раствор подвергался непрерывному перемешиванию с контролируемой скоростью и временем, которое составляло 1 минуту. Растворы хранились в холодильнике не более 20 суток.
В экспериментах использовались мыши линии F1(C57 x DBA2), ПМ выделялись из клеток печени методом последовательного центрифугирования по методу Лотен [30] с использованием перколла.
Концентрацию белка определяли по методу Лоури [31].
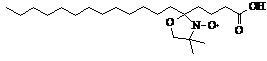
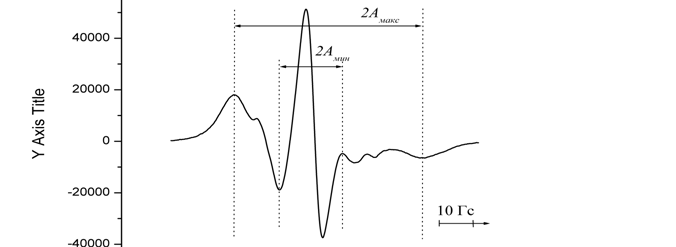
Структурное динамическое состояние мембраны изучалось методом спинового зонда [32,33] на ЭПР-спектрометре «Bruker EMX» (ФРГ) и описывалось вязкостными характеристиками при постоянной температуре 293К, такими как жесткость поверхностных областей липидов (~8Е), а также термоиндуцированными структурными переходами в этой области липидов. Искомые параметры рассчитывались из спектров ЭПР, полученных в результате трех накоплений, в полуавтоматическом режиме с помощью оригинальных программ в вычислительной среде Origin 6.1. В качестве спинового зонда для изучения жесткости поверхностных областей мембраны применялся стабильный нитроксильный радикал – 5-доксилстеариновая кислота (зонд С5) (рис. 1), конечная концентрация зондов в мембранах не превышала 6*10-5М.. Жесткость мембраны в области локализации этого зонда (~8Е) описывалась параметром упорядоченности S [33], зависящим от амплитуды отклонения большой оси эллипсоида вращения зонда от среднего направления ориентации окружающих молекул липидов:
|
|
где2Амакс и 2Амин расстояния между внешними и внутренними экстремумами спектра ЭПР (рис.1), погрешность измерения которых в хорошо разрешенном спектре не превышала 0,2 Гс.
|
5-доксилстеариновая кислота (зонд С5) |
|
|
|
|
|
Рис.1 Структурная формула и спектр ЭПР зонда С5 в плазматических мембранах клеток печени мышей. Концентрация белка 3 мг/мл. |
Термостатирование
образцов в резонаторе спектрометра ЭПР осуществляли с помощью термоприставки Bruker ER 4131 VT с точностью ±0,05 ˚С. Измерение параметров
спектров ЭПР, входящих в формулу для S (рис. 1), осуществляли в автоматическом режиме с помощью оригинальных
программ в вычислительной среде Origin 6.1 с использованием стандартных алгоритмов поиска экстремумов при
заданном шаге дискретизации 0,06 Гс. Так, погрешность измерения расстояния
между внутренним и внешними экстремумами в хорошо разрешенном спектре ЭПР зонда
С5 составляла 0,2 Гс, а суммарная ошибка вычисления отдельных
значений S по экспериментальным спектрам ЭПР
зонда С5, полученным в результате 3-х накоплений, не превышала 0,002
нсек. Среднее контрольное значение S в ПМ составляет 0,64±0,01, что по порядку величины совпадает с
немногочисленными данными других авторов [34-37]. Для каждой концентрации ФК было
произведено от 3 до 5 параллельных измерений на мембранах, выделенных независимо
друг от друга в различные времена года, а эффект выражался в процентах по
отношению к контролю.
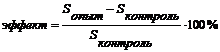
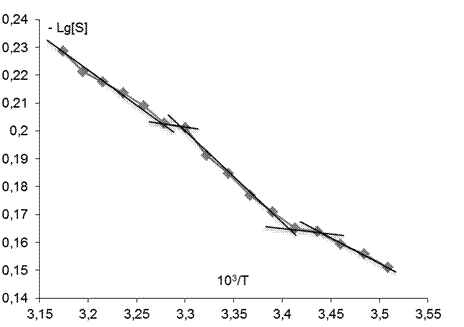
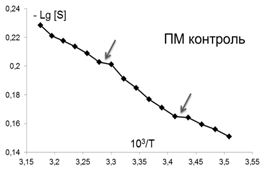
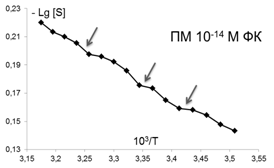
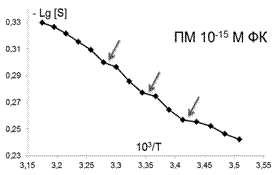
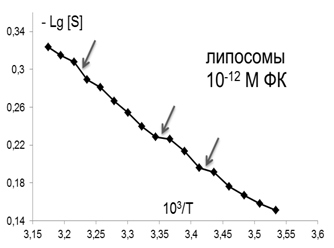
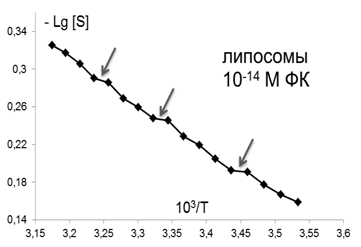
В качестве еще одной характеристики изменений, происходящих в мембране, использовалось представление о термоиндуцированных структурных перестройках («переходах») в липидном бислое, которые отображались точками излома между линеаризованными участками температурных зависимостей S зонда С5, представленных в Аррениусовых координатах–LgS от 1/Т [38] (рис. 2). Точками излома считали те точки, добавление которых к спрямленному участку графика выводило коэффициент корреляции за пределы норм, определяемых числом степеней свободы и статистической надежностью 95%.
|
|
|
Рис.2. Определение положения термоиндуцированных структурных переходов в липидах ПМ. В качестве примера взята температурная зависимость параметра S (зонд С5) в контроле |
Экстракция липидов из ПМ производилась методом Блайя и Дайера [ 39 ].
Приготовление липосом. Полученные экстракты липидов непосредственно после экстракции упаривались в вакууме в течение 3х часов. Затем количество липидов в образовавшейся пленке определялось взвешиванием с точностью ±0,1мг, и в зависимости от полученного значения доводилось буфером до концентрации 1,5 мг/мл для гидратирования, тщательно перемешивались на шейкере в течение 5 минут. Полученную суспензию обрабатывали ультразвуком на ультразвуковом процессоре Cole-Parmer-130 Watt EW-04714-51 в течение 15 минут, импульс 17 секунд, пауза 10 секунд, амплитуда 70%, согласно работе [40]. Полученные липосомы центрифугировали 20 минут при 13 000 об/мин на настольной микроцентрифуге Micro 22 R Hettich Zentrifugen при 4оС. Супернатант представлял собой готовые липосомы, которые затем хранились при 4оС и использовались для экспериментов в течение не более, чем 4 дня после приготовления.
Определение параметра упорядоченности S и положения термоиндуцированных структурных переходов в липосомах проводилось при тех же условиях, что и в экспериментах с ПМ.
Метод атомно-силовой микроскопии был использован для определения влияния ФК на форму и размеры липосом. Изображения липосом были получены с помощью атомно-силового микроскопа SOLVER P47, в полуконтактном режиме на частоте 150 кгц, с использованием кантилевера NSG 11. Измерения были проведены на воздушно сухих пленках липосом на поверхности кремния. При подготовке образца небольшая капля суспензии липосом (контроль или с заранее добавленным ФК) наносилась на подложку из полированного кремния. После высыхания на воздухе при комнатной температуре с поверхности удалялись следы сахарозы, содержащейся в буфере, с помощью кратковременной промывки поверхности образца на кремниевой подложке дистиллированной водой с дальнейшей воздушной сушкой. Количественная оценка размеров липосом и моделирование их трёхмерных изображений производилось с помощью программы NT-MDT Image Analysis.
Метод динамического рассеяния света (ДРС) применялся для определения размеров липосом в растворе. Измерения проводились на высокочувствительном анализаторе Zetasizer Nano ZS (фирма “Malvern Instruments”, Великобритания). Процедурa пробоподготовки обеспечивала необходимое “обеспылевание” растворов. Измерение размеров липосом предварялось контрольным исследованием свежеприготовленной бидистиллированной воды, которая использовалась только в том случае, если в ней было зарегистрировано полное отсутствие каких-либо частиц. Все эксперименты проводили в условиях термостатирования при 25°С. В опытах использовали липосомы с концентрацией липидов 1,5 мг/мл. Каждая проба измерялась от 7 до 10 раз с 15 накоплениями, всего проведено 13 серий экспериментов [ 42 ].
Статистическая обработка данных осуществлялась методами параметрической и непараметрической статистики с использованием пакетов компьютерных программ Microsoft® Office Excel и Origin® 6.1 при статистической надежности 95%.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ.
Влияние ФК на плазматические мембраны.
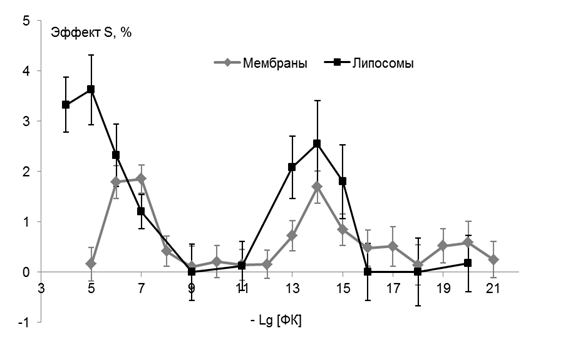
Вязкостные характеристики липидного бислоя при заданной температуре являются важными структурно-динамическими параметрами, влияющими на функциональную активность компонентов мембраны. В связи с этим мы провели эксперименты по исследованию влияния ФК на степень упорядоченности поверхностных областей (8 Е) липидов плазматических мембран при температуре 293 К. Полученные нами данные представлены на рис. 3 (серая кривая ) и выражены в процентах по отношению к контролю, каждая точка является результатом усреднения от 3 до 7 независимых измерений.
|
|
|
Рис. 3 Концентрационные зависимости эффекта ФК на степень упорядоченности поверхностных областей липидов в ПМ (серая кривая) и липосом, приготовленных из экстрагированных из ПМ липидов (чёрная кривая ) in vitro при постоянной температуре 293К. |
Дозовая зависимость для параметра упорядоченности S, свидетельствующего о степени жёсткости липидного окружения зонда С5 в ПМ (рис. 3, серая кривая ) является нелинейной, с двумя максимумами 10-6-10-7 М и 10-13-10-15 М, разделенными «мертвой зоной» 10-8-10-12 М, в которой эффекта не наблюдается. По абсолютной величине оба максимума приблизительно одинаковы ( 1,6-1,8%), и статистически достоверно отличаются от контроля ( р<0,05). Необходимо подчеркнуть, что величина S теоретически может изменяться в очень узких пределах : от 1 до 0, а на практике этот диапазон ещё уже. Поэтому изменения на 1-2 % в экспериментах in vitro являются достаточно существенными. Подобные модуляции обнаружены, например, в эритроцитарной мембране кроликов при экспериментальном атеросклерозе [35], у больных с ишемическо болезнью сердца [34] – патологиях, сопровождающихся значительным увеличением холестерина в этих мембранах. Таким образом, полученная дозовая зависимость имеет бимодальный характер, типичный для веществ, проявляющих эффект в СМД.
Сопоставляя полученную нами кривую с работами авторов, которые исследовали эффект ФК на других моделях, следует подчеркнуть, что, несмотря на разнообразие моделей, в большинстве экспериментов зафиксированы наибольшие эффекты ФК в концентрациях 10-4-10-5 М и 10-14-10-15 М. Это и влияние на активность мембраносвязанных ферментов ацетилхолинэстеразы [43] и лактатдегидрогеназы [28], на ПОЛ в микросомальных мембранах [26], на микровязкость поверхностных областей липидов мембран эритроцитов мышей [28], на их форму и объём [44], на продолжительность жизни животных с лейкозом [45]. Анализируя эти данные, можно сделать заключение о том, что наибольшее соответствие в эффекте ФК на различных моделях прослеживается с изменением параметра S в ПМ, установленным нами, и, вероятно, именно эти изменения приводят затем к модификации в функционировании и регуляторных систем, локализованных в ПМ, и, соответственно, торможению размножения клеток и роста опухоли, увеличения среднего времени жизни животных-опухоленосителей.
Сравнивая действие ФК на ПМ с влиянием природного антиоксиданта α-ТФ, использованного в тех же концентрациях нами ранее[46] , можно отметить следующее: дозовые зависимости эффектов этих веществ аналогичны, и в том, и в другом случае кривые имеют два максимума, положение на оси концентраций совпадает , эффект α-ТФ в 2 раза больше по абсолютным значениям (достигает 3%) и его максимум в области СМД несколько шире (10-12-10-17М). На основании этих данных можно сделать вывод о том, что ФК, как и α-ТФ, обладает стабилизирующим эффектом на поверхностные области липидов ПМ во всем исследованном интервале концентраций (10-5-10-21 М); дозовые зависимости эффектов для обоих препаратов носят нелинейный полимодальный характер.
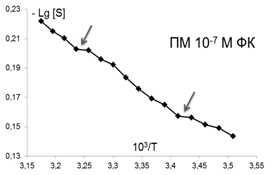
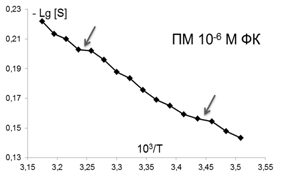
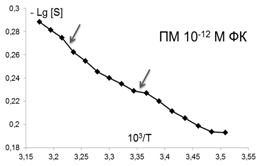
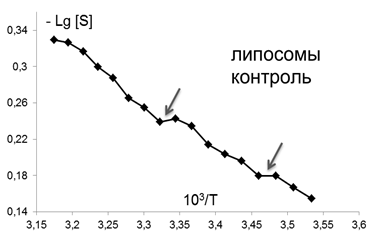
Помимо изменений вязкостных характеристик липидного бислоя при постоянной температуре, важными параметрами, описывающими происходящие изменения в динамическом состоянии мембраны, являются количество и качество термоиндуцированных структурных переходов в ней. Они представляют собой кооперативные структурные превращения групп липидов при повышении температуры, которые сопровождаются скачкообразным изменением параметра упорядоченности S липидного бислоя. Для выявления переходов были получены кривые зависимости S от температуры для контроля и концентраций ФК, которым соответствовали максимумы или отсутствие эффектов на дозовых зависимостях, полученных при температуре 293К, которые представлены в Аррениусовых координатах (рис.4).
|
|
|
|
|
|
|
|
|
Рис. 4. Температурные зависимости параметра S, характеризующего степень упорядоченности областей липидного бислоя (8 Е) ПМ в контроле и при действии ФК в концентрациях: 10-7,10-6,10-12, 10-14, 10-15 М . Стрелками отмечены положения термоиндуцированных структурных переходов. |
||
Полученные данные о влиянии ФК на термоиндуцированные структурные переходы в поверхностных областях липидов ПМ суммированы в таблице 1 (серый цвет).
|
Таблица 1. Положения термоиндуцированных структурных переходов в поверхностных областях (8 Е) липидного бислоя ПМ (серый цвет) и липосом (чёрный цвет), приготовленных из липидов ПМ, в контроле и при действии ФК in vitro в концентрациях 10-6, 10-7, 10-12, 10-14 и 10-15 М. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Из рис.4 и таблицы 1 следует, что в контроле в исследуемой области липидов обнаружено два перехода : 291-291 К и 303-305К. Эти результаты совпадают с данными литературы, полученными для ПМ как с использованием того же зонда, так и методом дифференциально-сканирующей калориметрии [47]. Действие ФК в относительно высоких, «физиологических» концентрациях ФК (10-6-10-7М), соответствующих максимуму на серой кривой рис 3 , приводила к сдвигу перехода 303-305 К на 4 градуса до 307-309 К. Для концентраций, соответствующих «мертвым зонам» на дозовых зависимостях на рис. 3, общее количество переходов не меняется, в поверхностных областях они сдвигаются по сравнению с контролем в область более высоких температур, в том числе и «физиологических»: (291-293 К) до (297-299 К), а (303-305К) до (309-311 К), 6 градусов - это весьма значительный сдвиг, который может приводить к изменениям в функционировании мембраны. СМД ФК, которым соответствовали максимумы на дозовых зависимостях при температуре 293К (рис 3), вызывают появление дополнительного третьего перехода при температурах 297-299К в поверхностных областях (при действии ФК в концентрациях (10-14-10-15 М). Учитывая важную роль фазовых переходов липидов биологических мембран в жизнедеятельности клетки (в изменении проницаемости мембраны, образовании пор, слиянии мембран, возбудимости нервных тканей и проведении нервного импульса по аксону, терморегуляции, синаптическом экзоцитозе и т.д. [48,49], эти эффекты ФК могут иметь регуляторное значение для живых систем.
Сравнивая изменения в положениях термоиндуцированных структурных переходов, вызванные действем ФК и α-ТФ по данным Белова с соавторами [46], важно отметить, что α -ТФ, в отличие от ФК, вызывает появление дополнительных переходов в области «физиологических» температур при действии во всех концентрациях, оказывавших наибольшее влияние на вязкостные характеристики мембраны на поверхности, ФК же вызывает появление дополнительных переходов только при действии в СМД.
Влияние ФК на структуру поверхностных слоёв липидов липосом, приготовленных из липидов, экстрагированных их ПМ.
ФК может изменять стуктуру ПМ как непосредственно встраиваясь в липидный бислой, так и взаимодействуя сначала с белками, встроенными в мембрану и затем опосредованно влияя на липиды. Для выяснения вопроса о том, какая же компонента мембраны является первичной мишенью действия ФК, мы провели эксперименты на липосомах, приготовленных из липидов ПМ. Для этого была проведена полная (99%) экстракция липидов из ПМ методом Блайя и Дайера, из суммарных липидов по методу, описанному выше, приготовлены липосомы и далее проведены эксперименты по определению изменения параметра упорядоченности S под действием ФК в интервале концентраций 10-20-10-4М. Как видно из рис.3, на котором чёрная кривая относится к изменениям в липосомам, дозовая зависимость, как и в случае использования ПМ, имеет нелинейный бимодальный характер с двумя максимумами: в интервале относительно высоких концентраций (10-4-10-5М) и СМД (10-12-10-15М). Необходимо отметить следующие особенности кривой для липосом по сравнению с кривой для ПМ : по абсолютному значению эффект ФК на липосомы или равен эффекту на ПМ ( в интервале СМД), или превосходит его более, чем в 1,5 раза ( в интервале высоких концентраций); максимум в области «физиологических» концентраций сдвигается в сторону их увеличения, что может быть связано с взаимодействием ФК с другими компонентами мембраны, которых нет в липосомах. В интервале СМД максимумы изменения параметра S в ПМ и липосомах практически полностью совпадают. На наш взгляд, полученное соответствие дозовых зависимостей для эффектов ФК на ПМ и липосомах, особенно сохранение максимума в интервале СМД, свидетельствует о том, что ФК непосредственно действует на липидную компоненту мембраны.
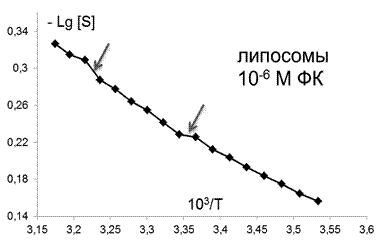
Для максимально действующих на параметр упорядоченности концентраций ФК были определены зависимости этой величины от температуры, которые представлены на рис. 5. Точки излома на кривых соответствуют положениям термоиндуцированных структурных переходов.
|
|
|
|
|
|
|
Рис.5. Температурные зависимости параметра S, характеризующего степень упорядоченности областей липидного бислоя (8 Е) липосом в контроле и при действии ФК в концентрациях: 10-6,10-12, 10-14М . Стрелками отмечены положения термоиндуцированных структурных переходов. |
|
Все полученные данные суммированы в таблице 1. Видно, что в контроле, как в ПМ, так и в липосомах, зафиксировано 2 перехода, в липосомах они сдвинуты в область более низких температур на 2 К. Высокие концентрации ФК (10-6М) вызывают весьма значительный (на 10 К) сдвиг перехода в области низких температур по сравнению с контрольными липосомами и на 4 К по сравнению с ПМ, обработанными ФК. Столь же значительные сдвиги вызывает эта концентрация ФК и в положении высокотемпературного перехода: по отношению к контрольным липосомам он также перемещается на 11 К в сторону более высоких температур, а по сравнению с ПМ, обработанными ФК в этой же дозе, на 1 К. Таким образом, из этих данных следует, что высокие дозы ФК значительно сильнее действуют на липосомы, чем на ПМ. ФК в концентрации, не изменяющей параметр S (10-12М), тем не менее оказывал влияние на структуру поверхностных слоёв липидов в липосомах, вызывая появление дополнительного термоиндуцированного перехода как по сравнению с контрольными ПМ, так и с липосомами, обработанными ФК в высокой концентрации (10-6М). СМД препарата (10-14M), индуцирующая максимальные изменения параметра упорядоченности в ПМ (рис.3 серая кривая ), приводила к появлению третьего перехода в липосомах в области физиологических температур (307-309 К). Таким образом, по критерию изменения положения термоиндуцированных переходов эффект ФК на липосомы проявляется в большей мере, чем на ПМ : наблюдается больший сдвиг имеющихся переходов и появление дополнительного перехода при использовании концентрации ФК, не влияющей на параметр S.
В совокупности результаты, полученные при исследовании влияния ФК на структуру липосом убеждают в том, что именно липидная компонента мембраны является мишенью фействия ФК в СМД.
Влияние ФК на диаметр липосом в растворе.
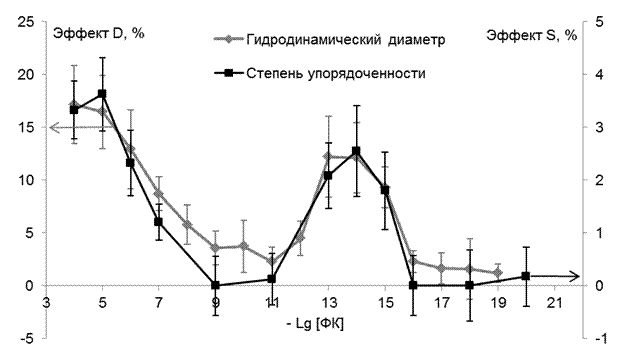
Возникает вопрос о том, каким образом отражаются изменения в физико-химических свойствах липосом на их размерах и форме. Для ответа на него были проведены эксперименты по определению диаметра липосом под действием ФК методом динамического светорассеяния. Для этого к контрольным липосомам, средний диаметр которых составлял 175,5 +\- 10,8 нм, последовательно добавляли растворы ФК, повышая его концентрацию в липосомах на порядок. После каждого добавления инкубировали липосомы с добавленным ФК в течение 20-30 минут ( ранее в опытах на ЭПР было показано, что ФК за это время полностью встраивается в липосомы) и производили измерения диаметра. Опыты повторялись 13 раз, причём в ряде экспериментов начальная концентрация ФК изменялась, что не повлияло на конечные результаты. Относительные эффекты ФК по сравнению с контролем представлены на рис.6., серая кривая .
|
|
|
Рис. 6 Изменение гидродинамического диаметра липидов под действием ФК в различных концентрациях (серая кривая) в процентах по отношению к контролю и параметра упорядоченности S в поверхностных областях липосом (чёрная кривая), в процентах по отношению к контролю.
|
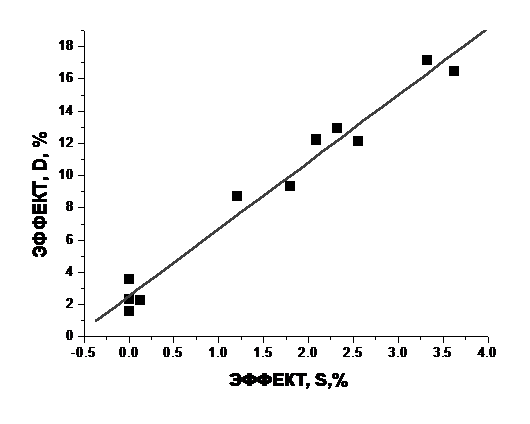
Из рисунка следует, что ФК (серая кривая) увеличивает (10-4-10-7 М) и (10-13-10-15М) либо не изменяет (10-9-10-11М) и (10-17-10-20М) средний диаметр липосом, увеличение составляет 12-20% и статистически достоверно по сравнения с контролем для 98% доверительного интервала. Характер полученной дозовой зависимости полностью идентичен кривой относительного изменения параметра упорядоченности поверхностных областей липосом (чёрная кривая ). Корреляция между этими кривыми представлена на рис. 7., r = 0,98, p = 0,0001. Таким образом, мы видим, что увеличение среднего диаметра липосом каким-то образом тесно связано с изменением жёсткости некоторых поверхностных липидных регионов липосом.
|
|
|
Рис. 7. Корреляция между влиянием ФК на параметр упорядоченности липидов S и относительным увеличеснием среднего диаметра липосом.
|
Влияние ФК на форму и размеры липосом, определяемое методом АСМ.
В предыдущем разделе речь шла о среднем диаметре липосом в растворе. Наряду с методом ДРС для оценки формы и размеров наночастиц используется метод атомно-силовой микроскопии (АСМ), который, однако рассматривает частицы после их помещения на соответствующую подложку и подсушивания, поэтому в принципе результаты, полученные этими двумя методами, не обязательно будут коррелировать. Тем не менее, мы провели такие исследования, так как метод АСМ даёт возможность рассмотреть каждую липосому индивидуально и определить её размеры после того, как она зафиксирована на кремниевой подложке. Автоматическая программа сканирования пластин даёт возможность суммировать данные по всем липосомам в поле зрения. В результате проведения измерений 17 контрольных образцов были получены данные, приведённые в таблице 2.
|
Таблица 2 Параметры контрольных липосом, приготовленных из липидных экстрактов ПМ (результаты 17 независимых экспериментов).. |
||||||||||||||||||||||||||||||||||||
|
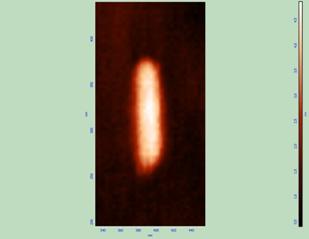
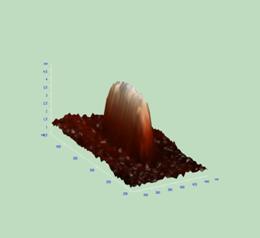
Из таблицы видно, что, несмотря на большое количество экспериментов и большое число измеряемых липосом в каждом эксперименте, средние значения таких параметров, как высота, площадь и объём варьируют в довольно широких пределах, что типично для липосом такого состава и размера [50,51]. Наиболее стабильным оказался такой параметр, как отношение длина/ширина, значения которого колебались в приемлемых пределах. Далее были проведены независимые измерения всех указанных в таблице величин, в 7 экспериментах для каждой концентрации ФК. Были выбраны следующие дозы препарата :10-6 и10-14М, соответствующие увеличению или достижению максимального эффекта для параметра упорядоченности S; 10-8 и 10-18М, когда ФК не изменял данный параметр («мёртвая зона»). Изображения имиждей липосом, полученных методом АСМ, в контроле и для указанных концентраций ФК, представлены на рис.7
|
А |
Б |
В |
|
|
|
|
|
Контроль, ФК 10-8 и 10-18М |
ФК 10-14М |
ФК 10-6М |
|
|
|
|
|
Рис. 7 Изменение формы липосом под действием ФК в различных концентрациях, верхняя часть рисунка –плоские изображения; нижняя часть рисунка (А и В) – объёмное изображение; Б – увеличенное изображение одной липосомы : А – контроль и действие ФК в концентрациях 10-8 и 10-18М, Б – действие ФК в концентрации 10-14 М; В – действие ФК в концентрации 10-6М. |
||
Из рисунка (часть А) видно, что липосомы имеют округлую форму, как при изображении в плоскости, так и при реконструированном объёмном изображении. Эта форма не изменяется при действии ФК в концентрациях 10-8 и 10-18М, это те концентрации ФК, которые не влияли ни на параметр упорядоченности поверхностных слоёв липидов, ни на гидродинамический диаметр липосом в растворе (рис.6). ФК в концентрациях 10-6 и 10-14 М приводил к «вытягиванию» липосомы, принятию ею палочкообразной формы (рис.7 Б; В), что хорошо заметно как при рассмотрении одиночной липосомы в плоскости ( рис.7Б, нижняя часть), так и в трёхмерном пространстве (рис.7В, нижняя часть). Таким образом, можно заключить, что ФК изменяет форму липосом, причём максимальное изменение формы (вытягивание) происходит при действии ФК в концентрациях, вызывающих наибольшее увеличение жёсткости в поверхностных слоях липидов. Проведение количественных определений размеров липосом на основании 7 независимых экспериментов позволило выявить наиболее достоверные изменения в отношении длина/ширина липосомы (рис.8).
|
|
|
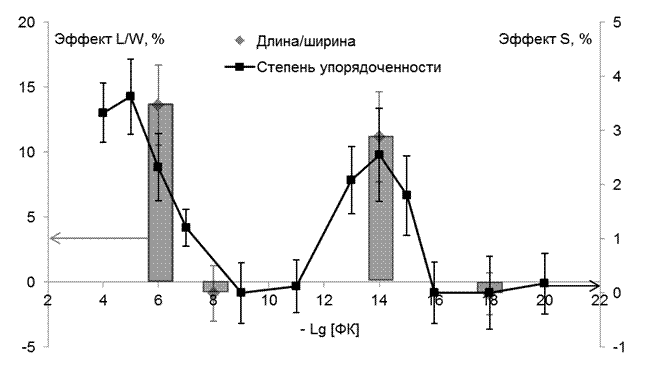
Рис.8 Влияние ФК на параметр упорядоченности в поверхностных слоях липосом (кривая с чёрными точками) и размеры липосом (отношение длина/ширина) (серые столбики), определённые методом АСМ. Все данные приведены как увеличение по отношению к контролю в процентах.
|
Видно, что концентрации ФК, не вызывающие изменения в структуре мембраны, соответственно, не влияют ни на форму, ни на отношение длина/ширина, в то время как концентрации ФК, приводящие к увеличению S , в такой же степени увеличивают отношение длина/ширина липосомы, что проявляется в изменении их формы (превращению округлого шарика в палочку).
Таким образом, методами ДСР и АСМ показано, что ФК изменят размеры и форму липосом, хорошо коррелирующее с изменением степени упорядоченности поверхностных областей липидов во всём исследованном диапазоне концентраций.
Роль воды в эффекте ФК в СМД.
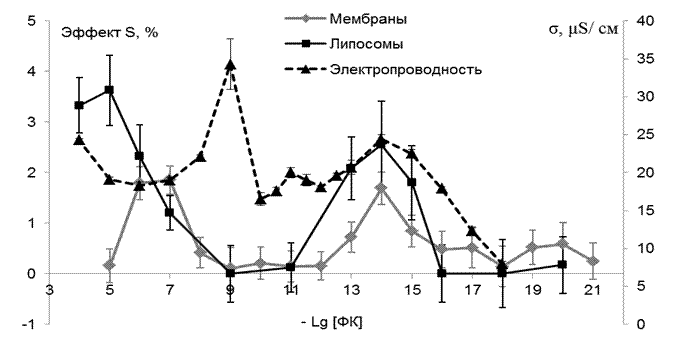
В качестве одного из механизмов эффекта БАВ в СМД ряд авторов рассматривает передачу информации через водную систему [52-57]. Ранее нами также было установлено, что влияние на биологические мембраны некоторых БАВ (токоферола, тиреотропин-рилизинг-гормона) в области СМД коррелировало со свойствами водных растворов БАВ в инфра-красной области спектра [58-59]; при использовании растворов токоферола в вазелиновым масле эффект препарата в СМД исчезал [60]. В некоторых работах [61-62] развиваются представления о наличии у гидрофильных поверхностей и частиц, в качестве которых могут рассматриваться и мембраны, “приповерхностных” слоев воды, отличающихся от “объемной” воды по вязкости, плотности, диэлектрической проницаемости, электропроводности. В частности, академиком Коноваловым А.И. с соавторами обнаружено, что многие БАВ с участием растворителя образуют в водных растворах наноассоциаты размером около 200 нм, причём концентрационные зависимости размеров наноассоциатов и удельной электропроводности растворов имеют полимодальный характер и взаимосвязаны [63;64]. Для выяснения вопроса о возможности образования наноассоциатов в водных растворах ФК и роли их физико-химических свойств в эффекте ФК в СМД представляло интерес сопоставление данных о размерах наноассоциатов ФК, удельной электропроводности его разбавленных растворов с их влиянием на структуру мембраны. В нашей совместной работе с Коноваловым А.И. и его сотрудниками было установлено [65] , что, действительно, изменение удельной электропроводности растворов ФК в зависимости от степени их разбавления представляет собой кривую с двумя максимумами: в области 10–9 М и 10–13–10–16 М, которые разделены областью снижения измеряемого параметра в интервале трех порядков концентраций (рис.9 пунктирная кривая ).
|
|
|
Рис. 9. Концентрационные зависимости влияния ФК на удельную электропроводность водных растворов; жёсткость поверхностных липидов плазматических мембран клеток печени и липосом, приготовленных из липидных экстрактов ПМ. |
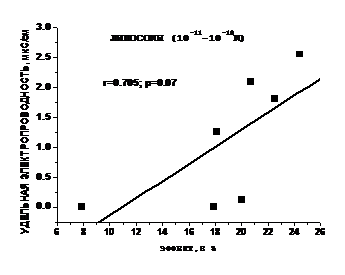
Максимум в интервале высоких концентраций значительно больше по величине, а в интервале СМД– более протяженный по концентрационной шкале. Таким образом, можно видеть, что и по данному критерию ФК проявляет свойства, присущие БАВ, действующим в СМД. Сравнивая дозовые зависимости для изменения жесткости ПМ и липосом ( рис.9 серая и чёрная кривые), и удельной электропроводности растворов ФК, можно отметить их аналогию, особенно в интервале концентраций 10–18–10–12 М, т.е.именно в той области, где ранее нами были обнаружены изменения в ИК_спектрах водных растворов других БАВ, α-токоферола и тиролиберина [58;59]. Из рис.9 следует, что в интервале относительно высоких концентраций ФК (10-4-10-9М) максимумы исследованных величин сдвинуты относительно друг друга, в то время как в интервале СМД наблюдается аналогичный ход всех трёх кривых. Для выявления количественной взаимосвязи между исследованными нами параметрами мы рассчитали коэффициенты корреляции для всего исследуемого интервала концентраций и для области 10–18–10–11 М (рис.10 ). Несмотря на то, что максимумы на кривых на рис. 9 в интервале относительно высоких концентраций 10–9–10–4 М сдвинуты друг относительно друга, мы получили удовлетворительную для биологических объектов корреляцию (r = 0.579, p = 0.0587) между изменениями удельной электропроводности водных растворов и жёсткости ПМ. Еще более высокий коэффициент корреляции выявлен для области СМД как для ПМ (рис.10 А) (r = 0.738, p = 0.05), так и липосом (рис.10 Б).
Эти данные свидетельствуют о том, что, несомненно, существует определенная взаимосвязь между эффектом БАВ, в данном случае ФК, и свойствами его растворов. Они также подтверждают сделанное нами ранее на основании экспериментов по ИК-спектроскопии водных растворов БАВ предположение о том, что изменения концентраций БАВ вызывают изменения в физико-химических свойствах воды [58;59]. Последнее, вероятно, обусловлено образованием и перестройкой в водных растворах БАВ наноассоциатов [63, 64], являющихся ассоциатами гидратированных ионов или молекул вещества и молекул или ассоциированных структур воды. С учетом полученных ранее авторами данных [63,64] очевидно, что при изменении концентрационных интервалов БАВ структура и свойства наноассоциатов меняются, что отражается на изменении величины общего эффекта, оказываемого раствором вещества на клеточные мембраны. Значительные флуктуации, обнаруженные в случае введения БАВ в СМД для выявления удельной электропроводности растворов и параметров мембран, указывают на возникновение нестабильности и, соответственно, создание неравновесных состояний в водной системе, которые могут в свою очередь влиять на физико-химические и биохимические свойства мембран.
|
А
|
Б
|
|
Рис.10 Корреляционные зависимости удельной электропроводности разбавленных растворов ФК и изменения жёсткости поверхностных слоёв липидов ПМ (А) и липосом (Б)в интервале СМД |
|
ВЫВОДЫ.
1. Установлено, что синтетический антиоксидант ФК вызывает увеличение параметра упорядоченности липидов S в области локализации зонда С5 в интервалах концентраций (10-6-10-7) М и (10-13-10-15) М как в плазматических мембранах клеток печени, так и в липосомах, приготовленных из липидных экстрактов ПМ, причём количественный эффект на липосомах превышает таковой на ПМ. Дозовые зависимости имеют нелинейный полимодальный характер, свойственный веществам, проявляющим эффект в сверхнизких концентрациях.
2. СМД ФК, которым соответствовали максимумы на дозовых зависимостях при температуре 293 К, ( 10-14-10-15 М для С5), по сравнению с контролем вызывают появление дополнительного термоиндуцированного структурного перехода в липидном бислое, а также сдвиги и уширения уже имеющихся переходов как при воздействии на ПМ, так и на липосомы.
3. Сопоставление результатов о влиянии ФК на структурное состояние ПМ и липосом позволяет сделать вывод о том, что мишенью действия препарата как в высоких концентрациях, так и в области СМД липидная компонента ПМ
4. По данным АСМ и ДРС, форма и размеры (увеличение среднего диаметра; отношение длина/ширина; превращение шарообразной формы в палочкообразную) у липосом меняются нелинейно при действии ФК в строгом соответствии с изменением степени упорядоченности поверхностных областей липидов (зонд С5, параметр S)
5. Наноассоциатные комплексы ФК с водой, образующиеся в разбавленных растворах ФК, их физико-химические свойства (электропроводность) являются материальным носителем, обеспечивающим проявление эффекта ФК в СМД.
ЛИТЕРАТУРА.
1. Ашмарин И.П., Каразеева Е.П., Лелекова Т.В. // Российский химический журнал. 1999. Том .XLIII. №.5. Стр.21- 28.
2. Зайцев С.В., Ефанов А.М., Сазанов Л.А. // Российский химический журнал. 1999. Том .XLIII. №.5. Стр.28-33.
3. Ямсков И.А., Ямскова В.П. // Российский химический журнал. 1998. Том 43 №5 Стр.85-90.
4. Бурлакова Е.Б., Конрадов А.А., Мальцева Е.Л. // Химическая физика. 2003. Том .22. №.1. Стр. 21-40.
5. .Пальмина Н.П, Кледова Л.В., Панкова Т.В., Мальцева Е.Л., Белов В.В.,Жерновков В.Е. // Вопросы биохимической, медицинской и фармакологической химии. 2004 №.4. Стр.31-37.
6. Жерновков В.Е., Богданова Н.Г., Пальмина Н.П. // Биологические мембраны. 2005. Том .22. Стр .388-395.
7. Жерновков В.Е., Богданова Н.Г., Лелекова Т.В., Пальмина Н.П. // Радиационная биология. Радиоэкология. 2003. Т.43. Стр .331-333.
8. Жерновков В.Е., Пальмина Н.П. // Труды V ежегодной международной молодежной конференция ИБХФ РАН – ВУЗЫ «Биохимическая физика», 14 – 16 декабря 2006 г., Москва, Стр. 12-17.
9. Полезина А.С., Аникиенко К.А., Курочкин В.К. // Российский химический журнал. 1999. Том .XLIII. №.5. Стр .72-79.
10. Владимиров И.А., Арчаков А.И. // Перекисное окисление липидов в биологических мембранах. М. Наука. 1972, Стр. 252.
11. Козлов И.П., Данилов В.С., Каган В.Е. // Свободнорадикальное окисление липидов в биологических мембранах. М. 1972, Стр. 88
12. Мальцева Е.Л., Пальмина Н.П. // Биологические мембраны. 1992. Том .9 Стр..1023-1025.
13. Мальцева Е.Л., Пальмина Н.П. // Радиационная биология. Радиоэкология. 2003. Том .43. Стр.301-305.
14. Рихирева Г.Т., Голубев И.Н., Прудченко И.А., Михалева И.И. // Биологические мембраны. 2003. Том .20. №5. с.409-418.
15. Пальмина Н.П., МальцеваЕ.Л., Бурлакова Е.Б. // Химическая физика, 1995, Том .14. №.11. Стр .47-60.
16. Жерновков В.Е., Пальмина Н.П. // Бюллетень экспериментальной биологии и медицины 200) Том 144, . Стр.151-155.
17. Пальмина Н.П., Пынзарь Е.И., Богданова Н.Г. // Биологические мембраны, 1995, Том.12, №2, Стр.185-193.
18. Бурлакова Е.Б., Крашаков С.А., Храпова Н.Г. // Биологические мембраны 1998, Том . 15№.1 Стр.137-168
19. Пальмина Н.П., Мальцева Е.Л., Курнакова Н.В., Бурлакова Е.Б. // Биохимия, 1994, Том .59, вып.2, Стр .193-210
20. Фаткулина Л.Д.б Воробьева А.К., Мишарина Т.А., Голощапов А.Н. // IV Междунар. Симпозиум «Механизмы действия СМД», 2008, Стр. 107-108.
21. Yada T., Sakurada M., Ihida K.,e.a. // J.Biol.Chem. 1994, V.269, P.1290 -1296
22. Белов В.В., Мальцева Е.Л., Пальмина Н.П. Биофизика // 2007, Том.52 №1 Стр.75-84
23. Белов В.В, Мальцева Е.Л., Пальмина Н.П., Бурлакова Е.Б. // Доклады Академии Наук РФ, 2004, Том..399. №.4. Стр.1 – 3.
24. Пальмина Н.П., Богданова Н.Г., Мальцева Е.Л., Пынзарь Е.И. // Биологические мембраны, 1992, Том.9 №8, с.810-820.
25. Мальцева Е.Л, Пальмина Н.П. // Биологические мембраны, 1992, Том.9, №10-11,Стр..1023-1025.
26. Пальмина Н.П., Кледова Л.В., Панкова Т.В., Гаинцева В.Д. // Радиационная биология. Радиоэкология. 2003, Том.43, № 3, с.310 – 314.
27. Молочкина Е.М., Озерова И.Б., Бурлакова Е.Б. // Журнал Менделеевского общества, 1999.Том 43 №5, Стр.. 63-71.
28. Трещенкова Ю.А., Голощапов А.Н., Бурлакова Е.Б. // Радиационная биология. Радиоэкология, 2003, Том.43,№3 Стр.320-323.
29. Мальцева Е.Л,.Пальмина Н.П,.Бурлакова Е.Б // Биологические мембраны, 1998, Том.15, №2, Стр.191-198.
30. Loten E.G., Redshaw-Loten J.C. // Analitical Biochem. 1986. V. 154. №1 P. 183-185.
31. Lowry O., Rosenbrouch N., Barr A., Randall R. // J. Biol. Chem. 1951. V. 193. P. 265-275.
32. Кузнецов А.Н. Метод спинового зонда. М.: Наука, 1976. 210 с.
33. Гриффит О., Джост П. // Метод спиновых меток. Теория и применение / Ред. Л. Берлинер. М.: Мир, 1979. С. 489-569.
34. Рууге Э.К., Герасимова Е.Н. // Метод спиновых меток. Проблемы и перспективы / Ред. Н.М. Эмануэль, Р.И. Жданов. М.:Наука, 1986. Стр.225-239.
35. Азизова О.А., Торховская Т.Н., Лопухин Ю.М. // Метод спиновых меток. Проблемы и перспективы / Ред. Н.М.Эмануэль, Р.И. Жданов. М.:Наука, 1986. Стр.239-249
36. .Petrovich D.R., Finkelshtein S., Waring A.J., Faber J.L. // J.Biol.Chem. 1984.V.259. P.13217-13223.
37. Паршина Е.Л., Гендель Л.Я., Рубин А.Б. // Биофизика. 2004. Т. 49. Стр. 1094-1098
38. Chapman D. // Quart. Rev. Biophys. 1975. V.8. P.185 – 191
39. Blaigh E.G., Dyer W.J. // Can.J.Biochem.Physiol. 1959. V.37. P.911- 914
40. Cimato A.N., Piehl L.L., Facorro G.B., Torti H.B., Hager A.A. // Free Rad.Biol.Med. 2004. V.37 P.2042-2051.
41. НТ-МДТ (www ntmdt ru)
42. Pecora R. // J.Nanopart.Res. 2000. V. 2. P. 123-131.
43. Молочкина Е.М., Озерова И.Б., Бурлакова Е.Б. // Журнал Менделеевского общества, 1999, №5, с. 63-71.
44. Бинюков В.И., Алексеева О.М., Миль Е.М., Албантова А.А., Фаттахов С.Г., Голощапов А.Н., Бурлакова Е.Б., Коновалов А.И. // Доклады Академии Наук, 2011. Том 441 №: 1 Стр. 245-247
45. Ерохин В.Н., Кременцова А.В., Семенов В.А., Бурлакова Е.Б. // Известия Академии Наук, 2007, № 5,Стр.. 583-590.
46. Белов В.В. , Мальцева Е.Л., Пальмина Н.П. // Биофизика. 2011. Том.56 № 2 Стр. 372-380.
47. Livingstone C.J., Schachter D. // J.Biol.Chem. 1980. V.255. P. 10902-10908
48. Антонов В.Ф., Смирнова Е.Ю., Шевченко Е.В. Липидные мембраны при фазовых превращениях. М.: Наука, 1992. Гл.4
49. Харакоз Д.П. // Успехи биологической химии. 2001. Т. 41. С. 333-364.
50. Palmer A.F., Wingert P., Nickels J. // Biophys.J. 2003 V.85. p. 1233-1247
51. Ruozi B., Tosi G., Leo E., Vandelli M. // Talanta. 2007. V. 73. P.12-22.
52. Khuda-Buksh, AR // Mol Cell Biochem 2003. Р. 253- 245.
53. Зубарева Г.М., Каргаполов А.В., Ягужинский Л.С. // ДАН. 2003. Том. 388№3 Cтр. 549–551.
54. Фесенко Е.Е., Терпугов Е.Л. // Биофизика. 1999. Т.44 С. 5-9
55. Ямсков И.А., Ямскова В.П., Даниленко А.Н. Клеменкова З.С., Антипов Б.Г., Черников Ф.Р., Гусынина М.М., Рыбакова Е.Ю.. // Рос. хим. журн. 1999. Том. 43.№5 Стр. 34–39.
56. Marchettini N., Giudict E., Voeikov V., Tiezzi E. // J.Theor .Biol. 2010 V.265. p. 511-516.
57. Лобышев В.И., Соловей А.Б., Бульенков Н.А. // Биофизика. 2003. Том. 48.№4 Стр. 1011-1021.
58. Zhernovkov V.E.; Roshchina I.A., Zubareva G.M., Shmatov G.P., Lokshin B.V., Palmina N.P. // Water. 2010. V.2 P.58-68
59. Белов В.В., Беляева И.А.,Шматов Г.П., Зубарева Г.М., Пальмина Н.П. .// ДАН. 2011. Том.439 № 1, Стр. 68–714
60. Белов В.В. , Мальцева Е.Л., Пальмина Н.П., Бурлакова Е.Б. // ДАН. 2004 Том.399 №1 С.1-3
61. Bing_hua, Chai., Jian_ming, Zheng., Quing, Zhao.,and Pollack, G.H. // J. Phys. Chem. A, 2008, vol. 112, pp. 2242–2247.
62. Pollack, G.// Jap. J. Phys., 2001, V.l. 51, P. 649–660.
63. Рыжкина И. С., Муртазина Л. И., Киселева Ю. В, Коновалов А. И. // ДАН . 2009 Том. 428 №4 Стр. 487-491
64. Irina S. Ryzhkina, Lyaisan I. Murtazina, Andrey V. Nemtarev , Vladimir F. Mironov Evgeny A. Katayevb, Alexander I. Konovalov // Chemical Physics Letters. 2011 V.511 №1 P. 247-250
65. Пальмина . Н.П.,. Часовская Т.Е,. Рыжкина И.С, Муртазина Л.И. , Коновалов А.И. // ДАН 2009. Том.429.№ 1 Стр. 128-131.