Адрес этой статьи в интернете: www.biophys.ru/archive/congress2012/proc-p80-d.htm
НОВЫЕ АДГЕЗИВНЫЕ БИОРЕГУЛЯТОРЫ, ВЫДЕЛЕННЫЕ ИЗ РЯДА ЛЕКАРСТВЕННЫХ РАСТЕНИЙ
Куликова О.Г., Ильина А.П., Краснов М.С., Ямскова В.П.1, Ямсков И.А.
Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений
им. А.Н. Несмеянова РАН
119991, Россия, Москва, ГСП-1, В-334, Вавилова, 28. e-mail: koulikova_olga@mail.ru
1Федеральное государственное бюджетное учреждение науки Институт биологии развития
им. Н.К. Кольцова РАН
119334, Россия, Москва, Вавилова, 26. e-mail: yamskova-vp@yandex.ru
На протяжении многих лет различные лекарственные растения используются человечеством для профилактики и лечения различного рода заболеваний. Растения являются традиционным источником получения различных биологически активных веществ и лекарственных средств, однако к настоящему времени недостаточно изучены и охарактеризованы. Во многих случаях не выявлены вещества, ответственные за проявление фармакологического действия. Поэтому поиск новых биологически активных веществ растительного происхождения остается актуальной проблемой современной науки. В этом аспекте особого внимания заслуживает выявление в растениях мембранотропных гомеостатических тканеспецифических биорегуляторов (МГТБ), которые были обнаружены ранее в различных тканях позвоночных животных. МГТБ отличаются, прежде всего, способностью влиять на основные биологические процессы: адгезию, дифференцировку, апоптоз, миграцию и пролиферацию клеток, причем биологическая активность характеризуется наличием тканевой, но отсутствием видовой специфичности и проявляется наиболее ярко в сверхмалых дозах (СМД), соответствующих 10-8-10-15 мг белка/мл.
В качестве основных объектов исследования в данной работе были взяты лук репчатый (Allium cepa L.), укроп пахучий (Anethum graveolens L.), подорожник большой (Plantago major L.), алоэ древовидное (Aloe arborescens M.) и чеснок (Allium sativum L.). Применив ранее разработанный для выделения и исследования мембранотропных гомеостатических тканеспецифических биорегуляторов (МГТБ) животного происхождения подход из различных тканей данных растений были выделены новые адгезивные биорегуляторы. Для исследования были взяты именно выше упомянутые растения, поскольку известно, что они способны оказывать различное лекарственное действие. Биологическое действие лекарственных растений находит применение при создании препаратов для профилактики и лечения различных заболеваний. Так, например, известно, что препараты из листьев подорожника весьма успешно используют в качестве ранозаживляющего средства, а препараты, полученные на основе лука, эффективно применяются при различного рода заболеваниях кишечника.
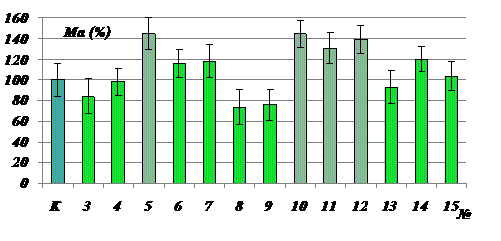
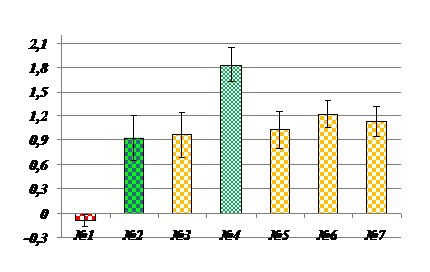
Аналогично МГТБ животного происхождения биорегуляторы, выделенные из растений, оставались в растворенном состянии в насыщенном растворе сернокислого аммония. Это было показано исследованием мембранотропной активности надосадочных жидкостей и осадков, которые получали путем высаливания соответствующих растительных экстрактов. На рис.1. в качестве примера приведена диаграмма, отражающая мембранотропное действие супернатанта, полученного из экстракта чеснока. Метод мембранотропной активности, который является методом биотестирования МГТБ животного происхождения, был использовании и для идентификации растительных биорегуляторов. Биологически активные супернатанты растительных экстрактов далее разделяли методами ИЭФ, обращенно-фазовой ВЭЖХ, электрофореза в ПААГ. Полученные фракции биорегуляторов идентифицировали методами биотестирования, изучали MALDI-TOF масс-спектрометрией, динамическим лазерным светорассеянием. В отдельных экспериментальных сериях изучали специфическую активность растительных биорегуляторов.
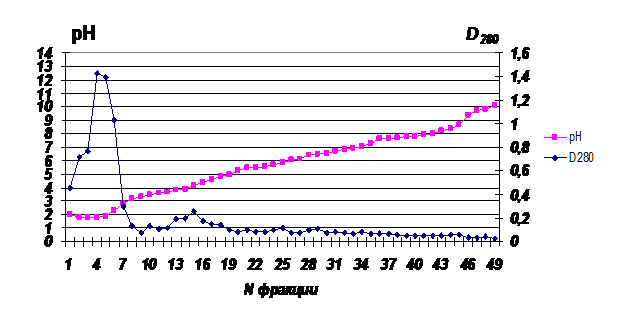
При ИЭФ растительные биорегуляторы так же, как и МГТБ животного происхождения были определены во фракции кислых белков (рН<3,0). На рис.2. представлена картина разделения супернатанта, полученного из экстракта подорожника при ИЭФ в градиенте рН 3,0-10,0.
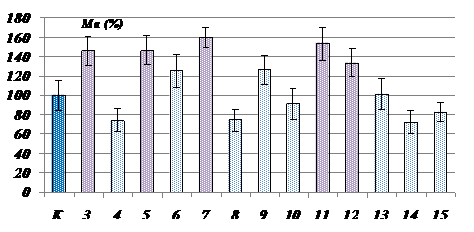
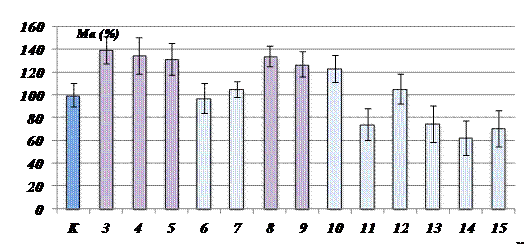
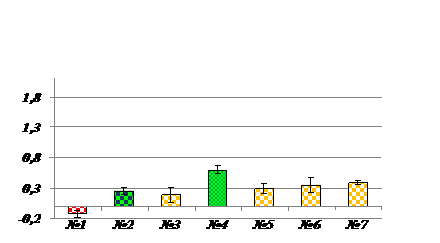
Полученные данные указывают, что наиболее количественно представленной ИЭФ-фракцией супернатанта растительного экстракта является фракция кислых белков. На рис.3. представлена диаграмма, отражающая мембранотропное действие ИЭФ-фракции.
|
|
|
Рис. 1. Мембранотропное действие супернатанта экстракта чеснока. По оси ординат – величина мембранотропного эффекта, Ма (%); по оси абсцисс – степень 10-кратного последовательного разведения изучаемого препарата, №; К - контроль; Биологически активные разведения отмечены фиолетовым цветом; (р< 0,05).Исходная концентрация препарата составляла 0,1 мг белка/мл. |
|
|
|
Рис. 2. Картина разделения супернатанта экстракта подорожника методом ИЭФ По оси ординат 1- значения рН; по оси ординат 2- D280; по оси абсцисс - номера фракций. |
|
|
|
Рис. 3. Мембранотропное действие ИЭФ-фракций супернатанта экстракта подорожника рН <3,0. По оси ординат – величина мембранотропного эффекта, Ма (%); по оси абсцисс – степень 10-кратного последовательного разведения изучаемого препарата, №; К - контроль; Биологически активные разведения отмечены фиолетовым цветом; (р<0,05); Исходная концентрация препарата составляла 0,1 мг белка/мл. |
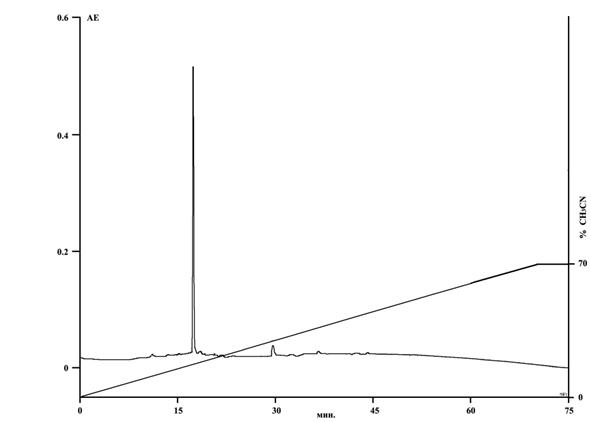
На рис.4. представлена картина разделения супернатанта экстракта лука методом обращенно-фазовой ВЭЖХ в градиенте вода-ацетонитрил. Наиболее представленной является фракция, элюированнная при 9% концентрации ацетонитрила. Методом биотестирования также было установлено проявление данной фракцией мембранотропной активности, характерной для МГТБ.
|
|
|
Рис. 4. Разделение супернатанта экстракта лука с помощью обращенно-фазовой ВЭЖХ. Колонка Jupiter C5 (2´150 мм). Элюцию осуществляли в градиенте концентрации ацетонитрила (0-70%) в 0,1%-ной трифторуксусной кислоте (pH 2,2) со скорость 0,3 мл/мин в течение 70 мин. Детекцию проводили при 210 нм. |
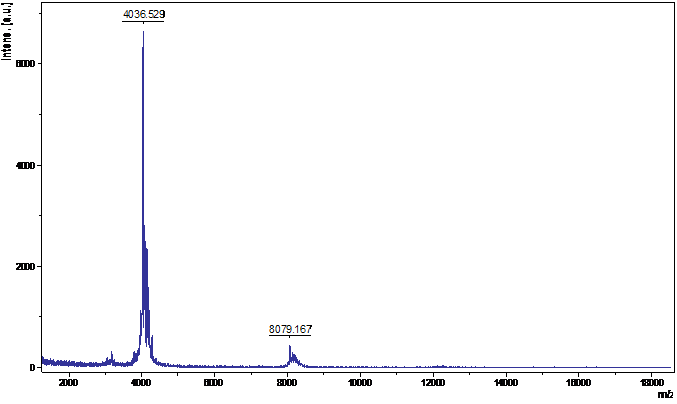
Методом MALDI-TOF масс-спектрометрии было установлено, что основным компонентном данной ВЭЖХ-фракции являлся пептид, молекулярная масса которого составила 4036±2 Да (рис.5.).
|
|
|
Рис. 5. MALDI-TOF масс-спектр ВЭЖХ-фракции супернатанта экстракта лука. |
Используя ферментативный гидролиз (карбоксипептидазой Y) изучаемого пептида с последующим MALDI-TOF масс-спектрометрическим анализом реакционной смеси, была установлена его 18-членная С-концевая аминокислотная последовательность:
-GlyPheGlyGluGlyAlaTyrThrGlyAlaValAlaAlaGlyThrGluGlyArg.
Уникальность структуры данного пептида была продемонстрирована при сравнительном анализе полученной С-концевой аминокислотной последовательности в базе данных Uniprot (http:// www.uniprot.org) полипептидов.
Исследование супернатантов растительных экстрактов методом динамического лазерного светорассеяния показало присутствие в водных растворах растительных биорегуляторов наноразмерных частиц. Следует отметить, что данная особенность является одной из характеристик МГТБ животного происхождения.
Для биорегуляторов растительного происхождения было показано существование в водных растворах частиц размером 88-110 нм (табл.1).
|
Таблица 1. Результаты исследования методом динамического лазерного рассеяния растворов супернатантов растительных экстрактов (концентрация 0,08-0,1 мг белка/мл) |
|
|
Объект исследования |
Значение гидродинамического радиуса частиц (нм) |
|
Подорожник большой |
110 ± 5,5 |
|
Лук репчатый |
99,2 ± 4,9 |
|
Чеснок |
101,7 ± 5,1 |
|
Укроп пахучий |
88 ± 4,4 |
Полученные результаты показывают, что в изучаемых фракциях, содержащих растительные биорегуляторы, несмотря на незначительное содержание белка (концентрация 0,08-0,1 мг белка/мл), образуются достаточно крупные наночастицы, размер которых соответствует размеру частиц МГТБ животного происхождения.
Методом MALDI-TOF масс-спектрометрии для всех супернатантов растительных экстрактов было показано присутствие небольших пептидов (табл.2).
|
Таблица 2. Идентификация пептидов, входящих в состав супернатантов растительных экстрактов, методом MALDI-TOF масс-спектрометрии |
||
|
Объект исследования |
М (m/z) |
Концентрация (мг белка/мл) |
|
Подорожник большой |
2374, 2963 |
0,064 |
|
Лук репчатый |
4036, 8079 |
2,69 |
|
Чеснок |
3061, 4367, 8743 |
0,79 |
|
Укроп пахучий |
1100, 1391, 2229 |
1,37 |
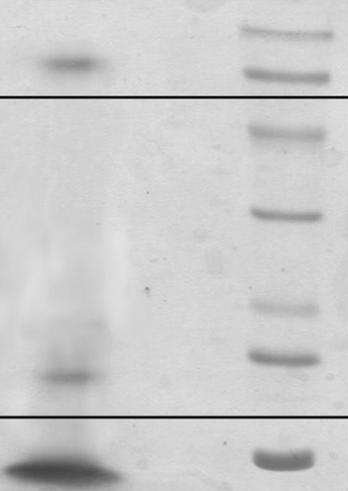
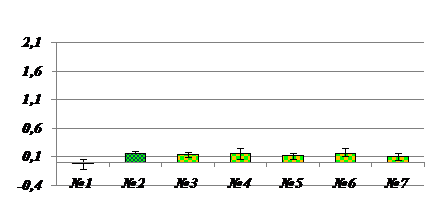
Данные MALDI-TOF масс-спектрометрии подтверждаются результатами исследования, проведенного методом электрофореза в ПААГ. На примере исследования ИЭФ-фракции, выделенной из подорожника, было показано, что основным компонентом является пептид с молекулярной массой приблизительно 2100 Да, который проявлял мембранотропную активность в СМД, характерную для МГТБ животного происхождения (рис.6,7).
|
67кДа 45кДа 3,5кДа 14,4кДа 21,5кДа 30кДа |
||||||||||||
|
Рис. 6. SDS-электрофорез в 7,5% ПААГ ИЭФ-фракции (рН<3,0) супернатанта экстракта подорожника. |
В качестве маркеров были использованы: окисленная В-цепь инсулина из поджелудочной железы быка - 3,5 кДа, α-лактальбумин – 14,4 кДа, соевый ингибитор трипсина – 21,5 кДа, карбоангидраза – 31 кДа, овальбумин – 45 кДа, бычий сывороточный альбумин – 66,2 кДа и фосфорилаза b – 94,6 кДа
|
№ |
||
|
Рис. 7. Мембранотропное действие низкомолекулярной (<3,5кДа) фракции супернатанта экстракта подорожника. По оси ординат – величина мембранотропного эффекта, Ма (%); по оси абсцисс – степень 10-кратного последовательного разведения изучаемого препарата, №; К - контроль; Биологически активные разведения отмечены фиолетовым цветом; (р<0,05). |
Таким образом, суммируя результаты проведенного исследования можно заключить, что, в растениях присутствуют ранее неизученные биорегуляторы, сходные по физико-химическим свойствам с МГТБ животного происхождения. Так же, как и МГТБ, растительные биорегуляторы находятся в растворенном состоянии в насыщенном растворе соли, в водном растворе присутствуют в состоянии достаточно крупных наноразмерных частиц, а в их состав входят биологически активные пептиды с небольшими молекулярными массами.
С помощью иммуногистохимической реакции с использованием вторичных FITC-конъюгированных антител были изучены локализации биорегуляторов, выделенных из подорожника, чеснока и лука в тканях соответствующих растений. Для изучения локализации биорегуляторов в листьях подорожника, чеснока и лука были получены поликлональные антисыворотки у кроликов, которые использовали в качестве первичных антител к растительным биорегуляторам. В качестве антигенов для иммунизации использовали биологически активную ИЭФ-фракцию кислых белков подорожника, а также супернатанты экстрактов чеснока и лука. Установлено, что растительные биорегуляторы локализованы внеклеточно.
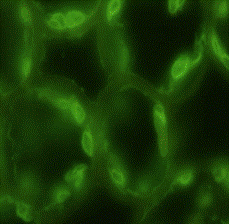
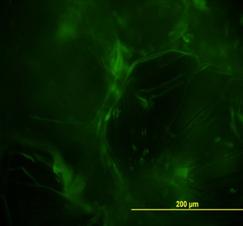
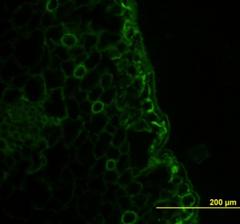
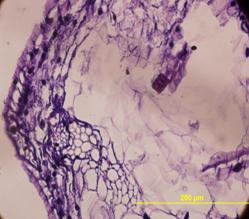
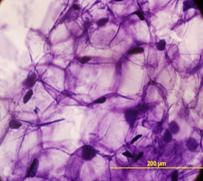
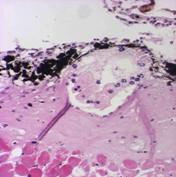
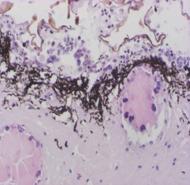
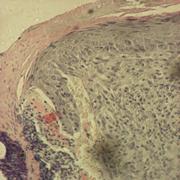
Рис.8. демонстрирует внеклеточную локализацию в ткани листа подорожника биорегулятора, выделенного из листьев подорожника. Яркое свечение на рисунке относится к неспецифическому свечению и принадлежит хлоропластам. На рис.9. так же приведена внеклеточная локализация в ткани луковицы лука биорегулятора, выделенного из луковицы лука. Результаты исследования биорегулятора, выделенного из луковицы чеснока, показали, что в листьях чеснока он локализован на поверхности клеток губчатого мезофилла и эпидермиса (рис.10). На рис.11. представлен гистологический срез ткани листа чеснока, который наглядно демонстрирует расположение клеток, на поверхности которых локализован биорегулятор. На рис.12. и рис.13, соответственно, приведены внеклеточная локализация в луковице чеснока биорегулятора, выделенного из чеснока, а также гистологический срез ткани данного растения. На рис.9. так же приведена внеклеточная локализация в ткани луковицы лука биорегулятора, выделенного из луковицы лука. Рис.8. демонстрирует внеклеточную локализацию в ткани листа подорожника биорегулятора, выделенного из листьев подорожника. На рис.11. и 13 представлены гистологические срезы тканей соответствующих растений, которые наглядно демонстрируют строение тканей данных растений.
Полученные данные представляются весьма важными в аспекте проводимого нами сравнения МГТБ животного происхождения и растительных биорегуляторов, поскольку и те и другие биорегуляторы локализованы внеклеточно, что позволяет предполагать об аналогии выполняемой ими функции, соответственно, в животных и растительных тканях.
Следует отметить, что в отличие от тканей животного происхождения адгезивные молекулы, а также различные макромолекулы межклеточного состава тканей растений мало изучены. На основании этого можно заключить, что полученные данные являются важными для понимания механизмов клеточной адгезии и проведения регуляторного сигнала в тканях растений. В этом аспекте весьма интересны результаты, полученные при изучении локализации биорегулятора, выделенного из чеснока. Была показана его локализация в области меристемы (группы образовательных тканей, отвечающих за гистологическое разнообразие тела растения), по сути, представляющей собой зону роста растения. Такая локализация растительного биорегулятора предполагает его участие в процессах роста (регенерации) растения. В связи с этим можно предположить о существовании еще одной аналогии, возможно наиболее принципиальной в плане сравнения функций растительных биорегуляторов и МГТБ животного происхождения, для которых была продемонстрирована способность влиять на клеточные источники регенерации в тканях и тем самым, стимулировать процессы восстановления и регенерации.
|
|
|
|
Рис. 8. Локализация биорегулятора, выделенного из листьев подорожника, в ткани листа подорожника (увеличение об. ×100, ок. ×10). Стрелками отмечена локализация биорегулятора. Наиболее яркое свечение принадлежит хлоропластам |
Рис. 9. Локализация биорегулятора, выделенного из луковиц лука, в ткани луковицы лука (увеличение об. ×40, ок. ×10). Стрелками отмечена локализация |
|
|
|
|
Рис.10. Локализация биорегулятора, выделенного из луковиц чеснока, в ткани листа чеснока (увеличение об. ×40, ок. ×10). Стрелками отмечена локализация биорегулятора |
Рис.11. Гистологический срез ткани листа чеснока (увеличение об. ×40, ок. ×10). Стрелками отмечены клетки, на поверхности которых локализован биорегулятор, выделенный из луковицы чеснока |
|
200μm |
|
||
|
Рис.12. Локализация биорегулятора, выделенного из луковиц чеснока, в ткани луковицы чеснока (увеличение об. ×40, ок. ×10). Стрелками отмечена локализация биорегулятора |
Рис.13. Гистологический срез ткани луковицы чеснока (увеличение об. ×40, ок. ×10). Стрелками отмечены клетки, на поверхности которых локализован биорегулятор, выделенный из луковицы чеснока. |
Для изучения специфической активности МГТБ ранее были разработаны новые модели роллерного органотипического культивирования тканей тритона (Pleurodeles waltl). Проведение этой серии экспериментов было обусловлено тканеспецифическим, но не видоспецифическим характером биологического действия МГТБ. В проведенных опытах было установлено протекторное действие биорегуляторов животного происхождения на ткань за счет дополнительной стимуляции в ней клеточных источников регенерации.
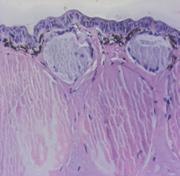
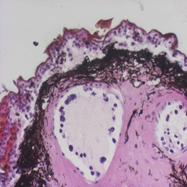
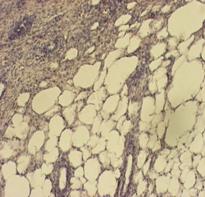
Известно, что подорожник и алоэ обладают ранозаживляющим действием. В связи с этим в данном исследовании была также использована модель роллерного органотипического культивирования кожи тритона. В эксперименте исследовали два биорегулятора, выделенные из подорожника и алоэ, соответственно, в виде ИЭФ-фракций (рН<3,0), в концентрациях, соответствующих 10-12 мг белка/мл. Результаты показали, что оба биорегулятора оказывали протекторное действие на ткань, которое после 7-суточного культивирования выражалось в поддержании структуры кожи, сохранении покровного эпителия, жизнеспособности и функций клеток желез. На данном сроке культивирования в культурах контрольной серии (без добавления биорегуляторов) обнаруживались явные признаки развития деструктивных процессов: наблюдали деградацию клеток эпидермиса (рис.14б).
|
а. |
б. |
|
||||||||
|
в. в. |
г. |
|
||||||||
|
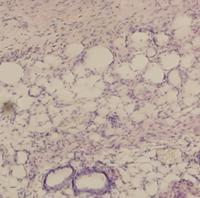
Рис. 14. Гистологические срезы кожи тритона: а - нативная кожа, б - роллерная органная культура на 7 сутки культивирования без добавления биорегулятора подорожника (контроль), в - роллерная органная культура на 7 сутки культивирования с добавлением биорегулятора подорожника (опыт), г - роллерная органная культура на 7 сутки культивирования с добавлением биорегулятора алоэ (опыт). |
|||||||||
В культурах опытных серий (при добавлении фракций изучаемых биорегуляторов) было обнаружено, что многослойный эпителий в составе активно секретируемой слизи покрывал поверхность фрагмента кожи (рис.14в,г). На границе эпителия и кориума отмечалось большое количество пигментированных клеток, число которых увеличивалось при неблагоприятных условиях в качестве защитной реакции организма. В кориуме были индентифицированы фибробласты, развитая сеть пигментных клеток, недеструктирующие железы; состояние ткани было приближено к нативному (рис.14а,в,г). Оба растительных биорегулятора способствовали усиленному образованию слизи, и, следовательно, слущиванию эпителия (рис.14в,г). В опытной группе распределение пигмента было равномерным, в отличие от контроля, где пигмент был представлен в виде глыбок и плотных скоплений под эпидермисом, что свидетельствует о более неблагоприятных условиях в контрольной среде и нарушении распределения меланофоров в кориуме.
Таким образом, характер специфической активности, проявляемый растительными биорегуляторами, проявляет аналогию с активностью МГТБ животного происхождения, например, с биорегулятором, выделенным из сыворотки крови: действие в СМД, поддержание структуры ткани и сохранение межклеточных адгезионных взаимодействий, увеличение жизнеспособности клеток и сохранение их функций.
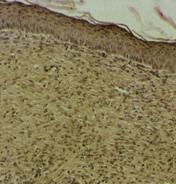
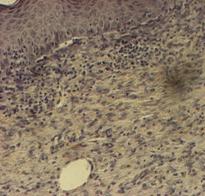
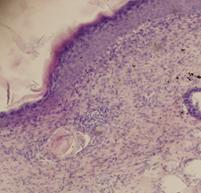
Наиболее выраженное протекторное действие биорегуляторов, выделенных из подорожника и алоэ, было продемонстрировано на модели экспериментальной травмы кожи мыши in vivo. У всех экспериментальных животных на спине наносили стандартную рану. Через 11 сутки после операции у всех экспериментальных животных наблюдали практически полную реэпителизацию раневой поверхности, незначительное воспаление в субэпидермальной зоне. У мышей контрольной группы (необработанная рана) происходило образование фиброзного рубца – отмечено параллельное эпидермису расположение коллагеновых волокон в виде плотных тяжей (рис.15а). При обработке раны физиологическим раствором также наблюдали образование соединительно-тканного рубца, однако в центральной части раны отсутствовало полное заживление и реэпитализация, поскольку образовался очаг хронического воспаления. В подкожной ткани практически не наблюдали жировых клеток; волокна коллагена были более рыхлые, чем в дерме (рис.15б). У мышей опытных групп (действие биорегуляторов, выделенных соответственно из подорожника и алоэ) наблюдали восстановление субэпидермальных слоев (рис.16а,б). Следует отметить комплексный характер репаративных процессов, протекающий при воздействии растительных биорегуляторов, по сравнению с контролем: наблюдали практически полное восстановление эпителия и дермы, в которой были отмечены кровеносные сосуды, а расположение волокон в дерме было более рыхлым, чем в контроле. Помимо этого, при воздействии фракций подорожника в подкожной жировой ткани отмечали интенсивное разрастание жировой ткани и восстановление протоков желез; в контроле на месте повреждения не происходило восстановления жировой ткани, а также не было восстановления протоков желез. Восстановление протоков потовых желез говорит о возобновлении их активности в данном участке кожи, а восстановление рыхлой структуры коллагеновых волокон в дерме свидетельствует о появлении эластичности кожи.
|
а. |
б. |
||||
|
|
|
||||
|
Рис. 15. Ранозаживление кожи мыши на 11 сутки после нанесения раны: а - без обработки раны (контроль); б - действие физиологического раствора. |
|||||
|
а. |
б. |
||||
|
|
|
||||
|
Рис. 16. Влияние ИЭФ-фракции (pH<3,0) растительных биорегуляторов на ранозаживление кожи мыши на 11 сутки после нанесения раны: а - подорожник; б - алоэ. |
|||||
Полученные данные показывают, что фракции, выделенные из подорожника, в СМД стимулируют ранозаживление у мышей in vivo, способствуя восстановлению нормальной морфологии кожи, без образования рубцовой ткани (рис.16).
В проведенном исследовании впервые было показано, что в тканях подорожника и алоэ присутствуют ранее неизученные биорегуляторы, которые проявляли в СМД свойственное данным лекарственным растениям биологическое действие.
Отдельной задачей исследования растительных биорегуляторов является определение их функции собственно в растениях. Результаты исследования локализации растительных биорегуляторов, приведенные выше, показали, что в сформировавшемся листе подорожника биорегулятор обнаруживается в межклеточном пространстве ткани, в то время как при интенсивном росте листьев чеснока растительный биорегулятор локализован в меристеме. В настоящей работе для оценки влияния растительных биорегуляторов на рост растений была применена модель проращивания семян. В данном исследовании нами были взяты супернатанты растворов биорегуляторов, выделенных из лука и укропа, в концентрации, соответствующей 10-14 и 10-12 мг белка/мл соответственно. Результаты эксперимента оценивали по биометрическим параметрам: высота побега, длина корня, вес побега, вес корня, всхожесть. В отдельных случаях комбинация параметров варьировалась в зависимости от возможности адекватного фиксирования того или иного параметра. Результаты данного исследования показали, что биорегулятор, выделенный из укропа, в СМД оказывал стимулирующее действие на семена фасоли, кориандра и укропа. Эффект варьировался от 3 до 86%. Как показано, в табл.3. наибольший эффект на вес стебля, вес корня и количество взошедших семян биорегулятор, выделенный из укропа, оказывал на семена фасоли и укропа; действие на семена кориандра было не столь эффективным, но оставалось достоверным (р<0,05) (табл.5).
Иные результаты были получены при исследовании биорегулятора, выделенного из лука, на рост семян гороха, чеснока, укропа и лука (р<0,05). В табл.4 приведены данные, которые показывают, что при воздействии данного биорегулятора наблюдали уменьшение веса корня и количества взошедших семян гороха, всхожести семян чеснока, длины и веса стебля, всхожести семян укропа, высоты побега и всхожести семян лука (р<0,05). Из табл.6. видно, что в отдельных случаях ингибирование роста семян достигало 31%.
Следует отметить, что как при стимулирующем действии биорегулятора, выделенного из укропа, так и при ингибирующем влиянии биорегулятора, выделенного из лука, отмечали изменение комбинации различных биометрических параметров семян: например, изменение длины корня, веса стебля, всхожесть и т.д. Однако общая тенденция при действии растительных биорегуляторов сохранялась, которая выражалась в достоверном изменении определенных параметров.
Таким образом, на основании результатов проведенного исследования можно заключить, что растительные биорегуляторы оказывают влияние на рост и всхожесть семян. Их действие может быть охарактеризовано как стимулирующее, так и ингибирующее. Очевидно, что это связано с источником выделения растительного биорегулятора и объектов его воздействия. Полученные данные указывают на актуальность более детального исследования данного вопроса. Можно предположить, что выбор пар «биорегулятор-мишень» для ряда растений позволит использовать эти знания для стимуляции одних видов растений и ингибирования других при полной экологической безопасности.
|
Таблица 3. Результаты проращивания семян при действии биорегулятора, выделенного из укропа, в концентрации, соответствующей 10-12 мг белка/мл, на 12 сутки культивирования |
||||||
|
Семена растения |
Биометрический параметр |
Контроль |
Опыт |
Эффект % |
|
|
Фасоль (Phaseolus L.)
|
Вес стебля (мг) |
411 ± 4,73 |
764 ± 4,87 |
86 |
|
|
Вес корня (мг) |
537 ± 5,16 |
725 ± 5,25 |
35 |
|
|
|
Всхожесть (шт) |
13 ± 2 |
22 ± 3 |
69 |
|
|
|
Кориандр (Coriandrum sativum L.) |
Высота побега (см) |
5,86 ± 0,4 |
6,03 ± 0,4 |
3 |
|
|
Вес побега (мг) |
167 ± 3,25 |
210 ± 3,69 |
25 |
|
|
|
Всхожесть (шт) |
91 ± 2 |
97 ± 2 |
6 |
|
|
|
Укроп (Anethum graveolens L.) |
Высота побега (см) |
4,41 ± 0,5 |
7,81 ± 0,6 |
78 |
|
|
Вес побега (мг) |
450 ± 0,48 |
560 ± 0,49 |
24 |
|
|
|
Всхожесть (шт) |
44 ± 2 |
61 ± 3 |
38 |
|
|
|
Таблица 4. Результаты проращивания семян при действии биорегулятора, выделенного из лука, в концентрации, соответствующей 10-14 мг белка/мл, на 12 сутки культивирования |
|||||
|
Семена растения |
Биометрический параметр |
Контроль |
Опыт |
Эффект % |
|
|
Горох (Pisum sativum L.) |
Вес корня (мг) |
127 ± 1,9 |
118 ± 3,6 |
3 |
|
|
Всхожесть (шт) |
62 ± 2 |
43 ± 3 |
31 |
|
|
|
Укроп (Anethum graveolens L.) |
Высота побега (см) |
5,2 ± 0,2 |
4,75 ± 0,2 |
9 |
|
|
Вес побега (мг) |
10,2 ± 0,03 |
8,9 ± 0,03 |
13 |
|
|
|
Лук (Allium сера L.) |
Высота побега (см) |
8,9 ± 0,2 |
7,8 ± 0,2 |
12 |
|
Реакция гиперчувствительности замедленного типа является одной из форм клеточного иммунного ответа организма. В данном исследовании на реакцию ГЗТ изучали биорегуляторы, полученные из алоэ, подорожника, лука, чеснока и лимона. В ходе эксперимента наблюдали увеличение реакции ГЗТ в опытных группах. Данный факт свидетельствует о стимуляции клеточного иммунитета: происходит активация CD4 T-клеток воспаления (Th1 клеток) и макрофагов, которые продуцируют цитокины. Все эти процессы, направленные на изоляцию патогена (или какого-либо иного антигена), завершаются за 24-48 часов формированием воспалительного очага.
Результаты исследования показывают, что на первый день измерения лап мышей биорегулятор, выделенный из подорожника, в данных условиях эксперимента усиливает сенсибилизацию к модельному антигену (гемоцианину), что выражается в увеличении реакции ГЗТ и воспалении примерно в 2 раза (рис.17а). Биорегуляторы, выделенные из других выше перечисленных растений имеют тенденцию к усилению реакции ГЗТ, однако, при статистической обработке оказались недостоверно отличимыми от группы с контрольной реакцией ГЗТ. На второй день измерения картина активности не менялась, биорегулятор, выделенный из подорожника, по-прежнему достоверно отличался от контрольного значения параметра (рис.17б). На рис.17в видно, что на третий день ответ иммунной системы на действие антигена нивелировался, реакция воспаления пропадала.
|
а. |
|
||
|
б. |
|
||
|
в. |
|
||
|
Рис. 17. Диаграмма, отражающая результаты эксперимента по проведению реакции ГЗТ. По оси абсцисс отложены номера групп, №; по оси ординат - М (средняя разница суммы правой и левой лап у мышей в группе). а – первый день эксперимента, б – второй день эксперимента, в – третий день эксперимента. Обозначение групп: №1-контроль, №2- ГЗТ, №3-биорегулятор, выделенный из алоэ, №4-биорегулятор, выделенный из подорожника, №5-биорегулятор, выделенный из лука, №6-биорегулятор, выделенный из чеснока, №7-биорегулятор, выделенный из лимона; данные достоверно отличимые от контрольной группы ГЗТ отмечены зеленым цветом; (р<0,05). |
|||
Следует отметить, что, не смотря на то, что гиперчувствительность замедленного типа указывает на активацию T-клеток, инфекция при этом не всегда ликвидируется, т.е. защитный иммунитет и гиперчувствительность замедленного типа не обязательно совпадают. Поэтому некоторые лица с гиперчувствительностью замедленного типа могут оставаться незащищенными от возможной инфекции.
Таким образом, данное исследование показывает, что биорегулятор, выделенный из подорожника, достоверно усиливается реакцию ГЗТ, т.е. способствует активации клеточного иммунитета.
Таким образом, впервые было показано, что в тканях ряда растений (подорожник большой, лук репчатый, чеснок, укроп пахучий, алоэ древовидное, кориандр посевной и лимон) присутствуют биорегуляторы, физико-химические свойства которых сходны с биорегуляторами, выделенными из тканей животных: они растворимы в насыщенном растворе сернокислого аммония, в их состав входят биологически активные пептиды, в водных растворах они присутствуют в виде наноразмерных частиц (до 110 нм). Биорегуляторы растительного происхождения проявляют мембранотропную активность, которая характеризуется полимодальной дозовой зависимостью и проявлением в концентрациях, соответствующих 10-4 - 10-15 мг белка/мл. Показано, что в состав биорегулятора, выделенного из лука, входит биологически активный пептид с молекулярной массой 4036±2 Да, 18-членная С-концевая последовательность которого является уникальной и представляет собой: -GlyPheGlyGluGlyAlaTyrThrGlyAlaValAlaAlaGlyThrGluGlyArg. Установлено, что биорегуляторы, выделенные из подорожника и алоэ, оказывают в концентрации, соответствующей 10-12 мг белка/мл, свойственное данным растениям протекторное действие на ткань кожи тритона (Pleurodeles waltl) in vitro при роллерном органном культивировании, которое выражалось в поддержании нормальной морфологии ткани кожи тритона, секреции желез, увеличение жизнеспособности клеток по сравнению с контролем. Показано, что биорегуляторы, выделенные из подорожника и алоэ, в концентрации, соответствующей 10-12 мг белка/мл, оказывают ранозаживляющее действие на кожу на модели экспериментальной раны у мышей in vivo.
Показано, что биорегуляторы, выделенные из лука репчатого и укропа пахучего, в концентрациях, соответствующих 10-14 и 10-12 мг белка/мл, оказывают влияние на рост и развитие семян ряда растений, причем характер этого действия может быть как ингибирующим, так и стимулирующим, соответственно. Методами иммуногистохимии показано, что растительные биорегуляторы локализованы внеклеточно: в листе подорожника биорегулятор, выделенный из подорожника, локализован в межклеточном пространстве ткани этого растения; биорегулятор, выделенный из луковиц чеснока, в листьях чеснока локализован на поверхности клеток губчатого мезофилла и эпидермиса; биорегуляторы, выделенные из луковиц лука и чеснока, также локализованы внеклеточно в тканях луковиц соответствующего растения. С помощью реакции на гиперчувствительность замедленного типа показана способность биорегулятора, выделенного из подорожника большого, стимулировать клеточный иммунитет.
A new adhesive bioregulators extracted from the range of officinal plants
Kulikova O.G., Il`ina A.P., Krasnov M.S., Yamskova V.P1., Yamskov I.A.
A.N.Nesmeyanov Institute of Organoelement Compounds of Russian Academy of Sciences
Russia, 119991, GSP-1, Moscow, V-334, Vavilova St. 28. e-mail: koulikova_olga@mail.ru
Koltzov Institute of Developmental Biology of Russian Academy of Sciences
Russia, 119334, Vavilova 26. e-mail: yamskova-vp@yandex.ru