Адрес этой статьи в интернете: www.biophys.ru/archive/congress2012/proc-p7-d.htm
ФАЗОВЫЕ ПЕРЕХОДЫ В СИСТЕМЕ НАФИОН-ВОДА
Н.Ф. Бункин1[a], С.Д. Захаров2, А.А. Зинченко1, П.С. Игнатьев3, В.А. Козлов1, А.В. Шкирин1
1Институт общей физики им. А.М. Прохорова РАН, 119991, ул. Вавилова, 38, Москва, Россия
2Физический институт им. П.Н. Лебедева РАН, 119991, Ленинский проспект, 53, Москва, Россия
3ООО Лаборатории «АМФОРА», 123557, 5-я Магистральная,11, Москва, Россия
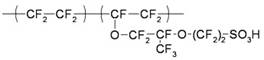
В настоящей работе исследовано новое фазовое состояние, которое формируется при контакте Нафиона и глубоко очищенной воды. Нафион представляет собой сополимер тетрафторэтилена и сомономера, имеющего боковые цепи перфторированного винилового эфира C2F4, оканчивающиеся сульфогруппами:
|
|
(1) |
здесь m - число боковых цепей [1]. В последнее время наблюдается резкий рост числа публикаций, посвященных свойствам Нафиона. Основная мотивация этих публикаций: Нафион используется в низкотемпературных водородных топливных элементах [2]. Наш интерес к исследованиям Нафиона был стимулирован работами Проф. Дж. Поллака из университета Штата Вашингтон, Сиэтл. В этих экспериментах было установлено, что если пластинка из Нафиона находится в контакте с водной суспензией коллоидных микросфер, эти сферы эффективно выталкиваются из объема воды размером порядка 150 микрон, примыкающей к поверхности Нафиона [3-5]. При этом граница между коллоидной суспензией и жидкостью, свободной от коллоидных частиц, очень резкая. Это позволило авторам назвать эту область исключенной зоной. Кроме того, внутри этой области был получен эффект двулучепреломления [6]. Дж. Поллак высказал предположение, что вблизи границы с Нафионом вода проявляет квазикристаллические свойства. Известно, однако, что вода на границе гидрофильных подложек может проявлять такие свойства только на масштабах порядка 1 – 2 молекулярных монослоев, т.е. в области порядка 10 нм, см., например, [7]. Наконец, вода в контакте с Нафионом проявляет ярко выраженные кислотные свойства [8]. Эти эксперименты делались с помощью растворения в воде красителя, цвет которого меняется в зависимости от рН. Отметим, что внутри самой исключенной зоны величину рН определить не удалось, поскольку частицы красителя, подобно коллоидным микросферам, также выталкивались из исключенной зоны.
Мы в наших экспериментах измерили величину рН и электростатический потенциал на границе с Нафионом. Эксперимент делался следующим образом. Сначала измерялась величина рН чистой воды, затем в эту воду помещалась пластинка Нафиона площадью 2´3 см2, и к ее поверхности прижимался рН-метр или точечный электрод для измерения электростатического потенциала. Характерные времена установления потенциала и величины рН составляют несколько десятков секунд. Головка рН-метра порядка 1 см, т.е. рН-метр меряет некоторое интегральное значение рН. При этом величина рН падает от 7 до 3, т.е. вблизи Нафиона действительно нарабатывается какая-то кислота, а потенциал меняется от нуля до -350 милливольт. Поскольку потенциал на поверхности Нафиона – отрицателен, можно предположить, что он в воде заряжается отрицательно за счет ухода в воду протонов. Действительно, известно, что при набухании Нафиона в воде в нем образуются пористые каналы, заполненные водой [9, 10]. Эти каналы богаты протонами (точнее – ионами Н3О+, Н5О2+ и т.д., поскольку, как хорошо известно, протонов в свободном виде в воде не существует). Вдоль границ этих каналов расположены ионизованные окончания сульфогрупп SO3-. При рассмотрении задачи о распределении плотности электрического заряда внутри таких каналов неизбежно возникает вопрос о сохранении квазинейтральности в объеме жидкого ионного раствора. По-видимому, можно считать, что если мы рассматриваем воду внутри каналов, поперечный размер которых порядка 10 – 100 нм, вопрос о сохранении квазинейтральности в объеме такой жидкости не столь критичен. Действительно, можно считать, что избыток положительного заряда в объеме жидкости скомпенсирован избытком отрицательного заряда на границах каналов, что обусловлено наличием ионов SO3-. Однако, в объеме жидкой воды на расстоянии ~ 100 микрон от поверхности Нафиона (масштаб исключенной зоны) также наблюдается избыток протонов, который должен быть скомпенсирован отрицательными ионами – кислотными остатками соответствующей кислоты. Возникает вопрос, что это за кислота или что является кислотным остатком? По-видимому, здесь должны играть какую-то роль концевые поверхностные сульфогруппы, которые способны диссоциировать в воде с образованием поверхностных ионов SO3-. Предположим, что происходит ступенчатая диссоциация поверхностных сульфогрупп:
[OCF2CFOCF2CF2]¾HSO3 + H2O Û […] + H+ + SO3- + H2O,
в результате которой в воду переходят сначала протоны, а затем – ионизованные сульфогруппы. Последнее (переход в воду ионов SO3-) может быть обусловлено избытком на поверхности Нафиона отрицательно заряженных сульфогрупп, т.е. эти ионы переходят в воду просто за счет Кулоновского отталкивания от поверхности. Мы отдаем себе отчет в том, что это фактически означает разрыв ковалентной связи [OCF2CFOCF2CF2]¾SO3-. Может ли такое произойти?
Чтобы ответить на этот вопрос, мы провели измерения рН вблизи поверхности Нафиона в кислых и щелочных водных растворах: оказалось, что в щелочных растворах величина рН вблизи Нафиона меняется особенно сильно в сторону уменьшения (т.е. кислотности), в то время как в кислых растворах величина рН вблизи Нафиона практически неизменна. Действительно, хорошо известно, что Нафион практически не растворим в кислотах, но хорошо растворим в щелочах. В щелочных растворах положительный ион щелочного металла может отобрать электрон, образующий ковалентную связь, и такая связь будет разорвана; в кислотах подобный эффект, очевидно, невозможен. Таким образом, кислая среда должна как-то стабилизировать Нафион по отношению к растворению. Следующий вопрос: какие свойства (кислые или щелочные) проявляет вода в контакте с Нафионом? Хорошо известно, что Нафион в целом не растворим в воде, но в течение первых нескольких часов набухания в воде его масса уменьшается на 1 – 2 %. На наш взгляд, это уменьшение массы Нафиона обусловлено именно формированием кислой среды: в дальнейшем масса Нафиона и величина рН не уменьшается, что было проверено в прямых экспериментах. В то же время, если вытащить пластинку Нафиона из воды, превратившейся в слабую кислоту, и вновь погрузить в нейтральную (рН = 7) воду, эффект повторится: величина рН этой воды в течение первых нескольких минут уменьшится, и затем выйдет на стационарный уровень. Таким образом, вода в контакте с Нафионом проявляет, по-видимому, щелочные свойства. Далее мы сформулируем два основных предположения, первое из которых: для своей стабилизации в воде Нафиону надо создать кислую среду; по нашему мнению, этой средой может быть сернистая кислота. Второе предположение: если за счет ионизации концевых сульфогрупп поверхность Нафиона в воде отрицательно заряжена, можно представить себе, что свернутые в клубки полимерные цепочки также будут отрицательно заряжены. Поэтому будут возникать Кулоновские силы, отталкивающие эти полимерные цепочки от поверхности в объем воды. Таким образом, в объеме воды вблизи полимера должен образовываться гидрогель – переходная фаза между жидкой водой и твердым полимером. Предполагая, что поперечный масштаб гидрогеля ~ 100 микрон, а характерный размер одного звена полимерной цепи ¾[(CFCF2)(CF2CF2)]¾ порядка нанометра, получаем, что число таких звеньев (число m в формуле (1)) должно быть порядка 105. При этом кислотные свойства внутри гидрогеля вблизи поверхности Нафиона должны быть выше, чем за пределами гидрогеля (глубоко в объеме жидкости), поскольку процесс диссоциации концевых сульфогрупп внутри гидрогеля происходит более активно вследствие развитой поверхности «полимер – жидкость» внутри гидрогеля.
Представленная ниже работа посвящена экспериментальному подтверждению этих двух гипотез. Проверка первой гипотезы основано на проведении качественных химических реакций, которые подтверждают наличие сульфит-анионов SO32- в воде вблизи Нафиона, и использовании ион-селективного электрода, который одновременно может измерять плотность сульфит- и сульфатов-анионов. Отметим сразу, что все качественные реакции на серную кислоту у нас не прошли, т.е. сульфат-анионы в обычных условиях эксперимента не возникают. В то же время, качественные реакции с перманганатом калия показали, что в воде вблизи поверхности Нафиона действительно могут возникать сульфит-анионы. Все качественные реакции проводись в 100 мл воды, в которой в течение 5 часов вымачивалась пластинка Нафиона 3´2 см2; при проведении реакции пластинка из жидкости изымалась. Кроме того, мы сделали электрохимическую ячейку с медными электродами и помещали между электродами пластинку из Нафиона. Если напряжение на электроды не подавалось, то никаких изменений в ячейке не происходило. В то же время, когда на электроды подавалось напряжение порядка 10 В на 2 см, анод покрывался слоем синего цвета, а сама жидкость приобретала голубоватый оттенок. После пропускания тока в жидкости прошли качественные реакции на наличие серной кислоты, откуда следует, что на аноде выделялся медный купорос, т.е. при наличии тока серная кислота в растворе нарабатывается. Известно, что серную кислоту можно получить в результате окисления сернистой кислоты; такое окисление происходит более интенсивно при пропускании тока. Отметим наконец, что ион-селективный электрод также подтвердил наличие в жидкости вблизи Нафиона либо сульфит- либо сульфат-анионов. Но поскольку в обычных условиях (в отсутствие тока) сульфаты отсутствуют, ион-селективный электрод может реагировать только ионы SO32-.
Этот электрод работает в температурном диапазоне от 5 до 45 С и снабжен термопарой, т.е. при обработке данных, полученных с его помощью, учитывается поправка на температуру. Преимущество такого электрода по сравнению с рН-метром в том, что он – точечный (размер измерительной головки порядка нескольких микрон), т.е. мы могли измерять локальное содержание ионов SO32- внутри и за пределами исключенной зоны. Эксперимент ставился следующим образом. Термостабилизированная кювета с водой (высота жидкости составляла 10 см) помещалась на столик с вертикальной микрометрической подачей; полный оборот микрометрического винта с высокой точностью соответствует 10 микронам. К поверхности Нафиона прижимался либо ион-селективный электрод, либо электрод для измерения электрического потенциала, и это положение электродов было фиксированным. Далее столик с помощью микрометрического винта опускался, и обе величины измерялись в функции расстояния между измерительной головкой и поверхностью Нафиона. Оказалось, что содержание сульфит-анионов и величина потенциала меняются скачкообразно: на расстоянии примерно 150 микрон эти величины резко выходят на нулевой уровень (эксперимент был поставлен при комнатной температуре). При этом на поверхности Нафиона потенциал отрицателен (-350 мВ), а объемная плотность сульфит анионов составляет несколько десятков мМ. В проверочных экспериментах, проведенных в отсутствие пластинки Нафиона в водных растворах Na2SO3 с различными концентрациями, никаких особенностей обнаружено не было. Напомним, что 150 микрон – это как раз масштаб исключенной зоны (согласно данным Дж. Поллака). Таким образом, размер исключенной зоны можно измерить по координате скачка концентрации сульфит-анионов и потенциала, т.е. по этой методике можно измерять масштаб исключенной зоны с достаточно высокой точностью. Отсюда также следует, что, измеряя эти величины, можно изучить размер исключенной зоны в функции температуры (во всяком случае, в диапазоне от 5 до 45 С).
Мы вначале проводили измерения плотности ионов SO32- и потенциала в воде на поверхности Нафиона. Сам Нафион хранился при комнатной температуре: примерно 22 С. Эксперимент ставился следующим образом: термостатированная кювета с водой охлаждалась до 5 С, затем в эту воду погружалась пластинка с Нафионом, которая набухала в течение 15 минут либо в течение 2 часов в пятиградусной воде, затем к пластинке прижимался ион-селективный электрод, и плотность сульфит-анионов измерялась в функции температуры при нагреве до 45 С, а потом эта же величина измерялась при охлаждении до 5 С. Оказалось, что динамика плотности сульфит-анионов зависит, от времени набухания, и от того, охлаждается жидкость или нагревается. Кроме того, при нагреве и охлаждении электростатический потенциал на поверхности Нафиона меняется подобным образом. Полученные в параллельных экспериментах одинаковые результаты убеждают нас в достоверности результатов.
Поскольку изначально Нафион хранится при комнатной температуре, возникает вопрос, «запомнил» ли Нафион эту температуру? Был проведен следующий эксперимент: пластинка Нафиона вымачивалась в воде при комнатной температуре, а затем температура повышалась до 45 С. В этом случае температурная зависимость плотности SO32- характеризуется своего рода петлей гистерезиса: при нагреве температурная зависимость плотности SO32- на границе с Нафионом немонотонна, в то время как при охлаждении каких-либо особенностей не наблюдается. Возникает вопрос, как ведет себя система в функции времени в точках, где наблюдается температурный гистерезис? Мы выбрали температуру внутри петли гистерезиса, для определенности взяли 28 С, и измерили зависимость плотности SO32- от времени при этой температуре. Оказалось, что плотность SO32- испытывает автоколебания с характерным периодом порядка 500 секунд. Можно (условно) считать, что эти автоколебания происходят между значениями концентрации SO32-, которые реализуются для данной температуре при охлаждении от 22 до 45 С и при охлаждении от 45 до 22 С. Можно, таким образом, предположить, что поведение концентрации внутри петли гистерезиса демонстрируют бистабильность, и спонтанные переходы из одного квазистабильного состояния в другое происходят в режиме, подобном автоколебаниям. При этом колебания плотности ионов должны сопровождаться низкочастотным электромагнитным излучением. Вопрос, откуда берется энергия для такого излучения? Возможно, при таких температурах реализуется какой-то специфический режим гидролиза Нафиона, и энергия высвобождается в результате протекания химической реакции (аналогично, например, реакции Белоусова – Жаботинского).
Вопрос, с чем может быть связано такое температурное поведение плотности сульфит-анионов в исключенной зоне? Хорошо известно, что для полимеров (так называемых термопластов), и, в частности, для Нафиона существует эффект shape-memory (см., например, [11]), который заключается в термической «закалке» полимера. Именно, если при определенной температуре к полоске полимера приложить растягивающее напряжение, пластинка, естественно, растянется. Если затем эту полоску начать охлаждать и при этом снять растягивающее давление, полоска может остаться в растянутом состоянии. Но если затем восстановить исходную высокую температуру, т.е. вернуться в состояние с более высокой энтропией, полимерные цепочки начинают вновь запутываться, что приводит к уменьшению длины, и полоска полимера примет свою исходную длину - растяжение исчезнет. Это и называется эффектом памяти формы полимеров, который для Нафиона наблюдается в диапазоне температур от 20 до 140 С. Этот эффект описывается в терминах комплексного модуля Юнга для Нафиона. Мы видим, что Нафион очень чувствителен к температурным изменениям. Но мы в наших экспериментах не изучаем свойства самого полимера: мы изучаем только свойства исключенной зоны вблизи его поверхности. Мы видим, что характеристики полимера фактически воспроизводятся в слое воды, прилегающем к полимеру. Наконец, необходимо сказать, что все эти результаты были получены с Нафионом толщиной 170 микрон. Те же эксперименты проводились с Нафионом толщиной 25 микрон, но в этих экспериментах практически не было замечено изменение плотности ионов SO32- в исключенной зоне. Таким образом, мы видим, что свойства жидкости в исключенной зоне обусловлены объемом Нафиона и площадью его контакта с водой, т.е. свойствами самого Нафиона. Это и позволяет нам говорить о том, что исключенная зона представляет собой своего рода переходное состояние (фазу) между собственно водой и твердым полимером: такой промежуточной фазой может быть гидрогель.
Описанные эксперименты убеждают нас, что исключенная зона представляет собой слабый водный раствор сернистой кислоты. Возникает вопрос, можно ли объяснить особые свойства жидкости в исключенной зоне (например, способность выталкивать коллоидные микросферы) исключительно наличием ионов SO32- и повышенным (по сравнению с обычной водой при комнатной температуре) содержанием протонов? Для того чтобы это выяснить, мы решили измерить коэффициент преломления n жидкости в исключенной зоне: эта величина, очевидно, должна зависеть от плотности ионов SO32-. Именно, мы знаем, что содержание ионов SO32- в исключенной зоне на границе с Нафионом порядка нескольких десятков мМ. Если величина n в исключенной зоне действительно меняется и эти изменения связаны с выделением сернистой кислоты, то это будет понятно из калибровочной зависимости для n водного раствора H2SO3 от концентрации. Мы не смогли достать сернистую кислоту, поэтому с помощью рефрактометра Аббе мы построили концентрационную зависимость n водного раствора Na2SO3. Оказалось, что величина n в присутствии ионов SO32- должен слегка возрастать: при концентрации 0.03 М (это примерно соответствует плотности этих ионов в исключенной зоне) n = 1.334, т.е. изменения происходят в третьем знаке после запятой. В то же время, измерения величины n в слое воды вблизи Нафиона, выполненные в схеме модуляционного интерференционного микроскопа (эта методика была подробно описана в нашей работе [12]), показали, что на лине волны l = 532 нм величина n на границе с Нафионом равна 1.46; отметим, что этот результат зависит от температуры и величины рН. Размер области, внутри которой величина n имеет повышенное значение, порядка 50 микрон, что – меньше размера исключенной зоны. На наш взгляд, это связано с размерными эффектами, которые проявляются при набухании Нафиона в воде.
Из эксперимента по рефрактометрии следует, что рост величины n не может быть объяснен повышением плотности ионов SO32-. Для того, чтобы при комнатной температуре столь существенно изменился коэффициент преломления воды (напомним, что на этой длине волны n = 1.33), необходимо сжать воду давлением в несколько десятков тысяч атмосфер, поскольку вода практически несжимаема, см. [13]. Рост величины n также не может быть связан с растворением Нафиона, поскольку коэффициент преломления «сухого» Нафиона составляет 1.36, см. [14]. Наконец, мы сделали эксперимент по пропусканию лазерного излучения сквозь кювету с водой в скрещенных поляризаторах (также в схеме микроскопа). Оказалось, что вблизи границы с Нафионом образец с водой пропускает излучение, т.е. вода действительно обладает свойством двулучепреломления. Таким образом, Нафион, взаимодействуя с водой, формирует в своей окрестности особую область (исключенную зону) обладающую фазовыми свойствами, отличными от свойств сухого Нафиона и воды. Отметим, что этой новой фазой может быть гидрогель, поскольку в гидрогелях наблюдается сдвиговая вязкость, т.е. такие среды могут обладать двулучепреломлением.
Выводы
В экспериментах по измерению объемной плотности сульфит-анионов и электростатического потенциала вблизи поверхности Нафиона подтвердилось наличие исключенной зоны: ее размер ~ 150 микрон. Плотность сульфит-анионов является параметром, который легко может быть измерен экспериментально, что переводит измерения размера исключенной зоны на качественно новый уровень. В то же время, вопрос о происхождении исключенной зоны остается невыясненным. В экспериментах по измерению температурной зависимости плотности ионов SO32- в исключенной зоне было получено, что эта величина при данной температуре определяется тем, как эта температура достигнута: в результате нагрева или охлаждения. При измерении температурных зависимостей плотности ионов SO32- на границе с Нафионом при нагреве и охлаждении были обнаружены температурные гистерезисы, которые свидетельствуют о наличии мультистабильности. Полученные результаты могут быть связаны с известными в физике полимеров эффектами памяти формы. Если это так, то следует признать, что термомеханические свойства полимеров передаются прилегающему слою воды. На границе Нафиона в воде существенно возрастает коэффициент преломления. Этот эффект не может быть связан ни с растворением Нафиона, ни с повышением концентрации ионов SO32-. Было установлено, что жидкость в этой области обладает двулучепреломлением. Это подтверждает, что вода вблизи Нафиона обладает квазикристаллическими свойствами. Полученные результаты позволяют нам сформулировать гипотезу, что исключенная зона – это слой гидрогеля.
Литература
1. K.A. Mauritz, R.B. Moore, Chem. Rev., 104, 4535 (2004).
2. C. Heitner-Wirguin, Journal of Membrane Science, 120, 21 (1996).
3. B. Chai, J. Zheng, Q. Zhao, G.H. Pollack, J. Phys. Chem. A 112, 2242 (2008).
4. B. Chai, G.H. Pollack, J. Phys. Chem. B, 114, 5371-5375 (2010).
5. J. Zheng, W.C. Chin, E. Khijniak, E. Khijniak Jr., G.H. Pollack, Advances in Colloid and Interface Science, 127, 19 (2006).
6. H. Yoo, D.R. Baker, C.M. Pirie, B. Hovakeemian, G.H. Pollack, Characteristics of water adjacent to hydrophilic interfaces, Ch. 7, In: Water: The Forgotten Biological Molecule, Edited by D. Le Bihan and H. Fukuyama, Copyright © 2011 by Pan Stanford Publishing Pte. Ltd.
7. B.W. Ninham, P. Lo Nostro, Intermolecular Forces and Self Assembly in Colloid, Nano Sciences and Biology; Cambridge University Press, New York, 2010.
8. B.Chai, H.Yoo, G.H. Pollack, J.Phys.Chem. B 113, 13953 (2009).
9. K. D. Kreuer, J. Membr. Sci., 185, 29 (2001)
10. J.A. Elliott, S.J. Paddison, Phys. Chem. Chem. Phys., 9, 2602 (2007)
11. T. Xie, Nature Letters, 464, March 2010, doi:10.1038/nature08863
12. N.F. Bunkin, N.V. Suyazov, A.V. Shkirin, P.S. Ignatiev, K.V. Indukaev, J. Chem. Phys., 130, 134308 (2009).
13. K. Vedam, P. Limsuwan, Phys. Rev. Lett., 35, 1014 (1975).
14. N. Pantelic, C.M. Wansapura, W.R. Heineman, C.J. Seliskar, J. Phys. Chem. B 109, 13971 (2005).