Адрес этой статьи в интернете: www.biophys.ru/archive/congress2012/proc-p128-d.htm
ВЛИЯНИЕ ЭЛЕКТРОХИМИЧЕСКИ АКТИВИРОВАННОЙ ВОДЫ НА РАСТИТЕЛЬНЫЕ БИОСИСТЕМЫ
Александрова Э.А., Шрамко Г.А., Красавцев Б.Е.
Кубанский госагроуниверситет, 350044 Краснодар, Калинина 13, alex2e@yandex.ru
Биологическая материя в значительной степени состоит из воды, и большая часть биологических молекул в животных и растительных системах функционирует, находясь в воде. Технологии промышленных и сельскохозяйственных производств основаны преимущественно на применении воды. Поэтому большой научный и практический интерес имеет исследование особенностей изменения свойств воды путём её электрохимической активации (ЭХА) и влияния ЭХА воды на растительные биосистемы, представленное в данной работе. Существуют различные способы активации воды: дистилляция, замораживание с последующим оттаиванием, омагничивание, световая, ультразвуковая обработка, электролиз и др. В результате отмечаются новые физико-химические и биологические свойства воды, влияющие на кинетику происходящих в ней реакций, изменяющие её растворяющую и моющую способность, а также биологическую и лечебную активность. Это позволило такую воду называть активированной [1], а в случае электролизного воздействия – электрохимически активированной водой (ЭХАВ) [2]. Под активацией воды и других систем в результате внешних воздействий следует понимать термодинамически неравновесное состояние системы, в которой запас внутренней энергии оказывается избыточным по сравнению с его значением в состоянии равновесия. Неравновесное состояние при определённых температуре и давлении может существовать длительное время. При этом меняются физико-химические и другие свойства воды. Электрохимическая активация (ЭХА) воды как технологический процесс представляет собой электролизное получение в заданном режиме и последующее применение электрохимически активированной воды (ЭХАВ) с заданными свойствами в различных отраслях народного хозяйства в качестве более эффективного реагента или реакционной среды.
Электрохимически активированная вода (ЭХАВ) получила наибольшую известность в 70-е годы XX века как «живая» и «мёртвая». Её получают в диафрагменных электролизёрах контактным и бесконтактным методами: в прикатодном пространстве – «живую» или католит со щелочной средой и отрицательным значением окислительно-восстановительного потенциала ОВП, в прианодном – «мёртвую» или анолит с кислой средой и положительным значением ОВП. В начале XXI века ЭХАВ получает второе рождение. Её начинают использовать не только в медицине, как это было ранее, но и в других отраслях промышленности и сельского хозяйства. В частности, нами успешно применяется католит для некорневой подкормки растений озимой пшеницы [3, 4] и плодовых деревьев [5], анолит используется при гидратации подсолнечного масла для более эффективного выделения фосфолипидной эмульсии. При этом возникает необходимость более подробных исследований свойств ЭХАВ, выявления более рациональных и экономичных условий её применения. Как показал литературный и патентный поиск, целенаправленных исследований электрохимических характеристик рН и ОВП католита и анолита проведено крайне мало. При этом разные авторы используют различные электроды и аппараты (часто самодельные), разнообразные водные системы, что не позволяет сопоставлять опубликованные данные. Данная работа восполняет указанный пробел. Нами изучались практически важные свойства рН и ОВП ЭХАВ, получаемой в диафрагменном электролизёре Мелеста-М, серийно выпускаемом Уфимским заводом (ТУ 5156-002-32064510-07) и широко рекламируемом в Интернете.
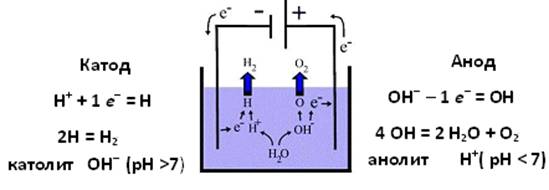
Схема анодного и катодного процессов при электролизе воды приведена на рис. 1, научно обоснованной в литературе [6,7].
|
|
|
Рис. 1 - Схема анодного и катодного процессов при электролизе воды |
У поверхности анода происходит окисление ОН– с выделением О2 и образованием кислой среды анолита. В катодной зоне восстанавливаются катионы Н+ и происходит выделение газообразного Н2 с образованием щелочной среды католита. Так как катодная и анодная зоны в электролизёре разделены диафрагмой, то католит и анолит отбираются каждый самостоятельно как целевые продукты.
Количественными электрохимическими характеристиками ЭХАВ служили окислительно-восстановительный потенциал (ОВП) и водородный показатель рН. Следует отметить, что концентрация ионов водорода, фиксируемая в водных средах с помощью рН, имеет большое значение для развития и жизнедеятельности поливных растений, изменения токсичности загрязняющих веществ и эффективности регуляторов роста. В ряде отраслей промышленности величина рН определяет возможность протекания и направленность технологических процессов, являясь основным параметром, регулирующим их кинетические и экономические характеристики. Величина ОВП определяет электронодонорную активность католита и электроноакцепторную способность анолита. Отрицательные значения ОВП свидетельствуют о наличии доноров электронов в водной среде и возможном протекании процессов восстановления. Положительные значения ОВП означают протекание окислительных процессов, сопровождающихся потерей электронов.
Основная задача изучения электрохимических характеристик ЭХАВ заключалась в выявлении зависимости рН и ОВП католита и анолита от длительности электролиза исходной водопроводной воды, периода их релаксации, а также от состава их бинарных смесей и степени разбавления их исходной водопроводной водой в широких пределах.
1. Результаты исследований
Методы исследований. Для изучения ЭХАВ была отобрана простая проба питьевой воды из водопроводной сети КубГАУ объёмом 5 литров. Пробоотбор и хранение воды осуществлись в соответствии с требованиями, описанными в сборнике [8, с.7–11] и книге [9, с. 98–100]. Получаемые католит и анолит немедленно переливали в стеклянные ёмкости, плотно закрывающиеся пластмассовыми пробками, откуда брались пробы на анализ в соответствии с задачей эксперимента. Потенциометрические измерения рН и ОВП проводили с помощью универсального измерителя рH-метра Sartorius Professional Meter PP-25. Индикаторным электродом для измерения рН служил ионоселективный электрод «Эком-рН». В качестве электрода сравнения использовали хлоридсеребрянный «ЭВЛ-1М3». Для определения ОВП рабочим электродом служил комбинированный платиновый электрод Sartorius PY-R01 (концерн Sartorius AG, Германия). Анализы проводились в температурном интервале 20–25оС в соответствии с техническим паспортом прибора и методикой, описанной в книге [10, с.165-166]. Погрешности анализов рН и ОВП (Р=0,95; n=10) составляли соответственно не более ±0,001 и ± 0,1 мВ.
1.1. Исследование влияния длительности электролиза воды и последующей релаксации на рН и ОВП католита и анолита
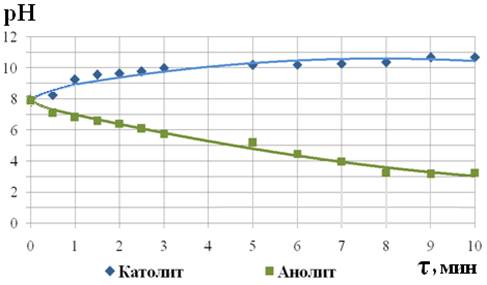
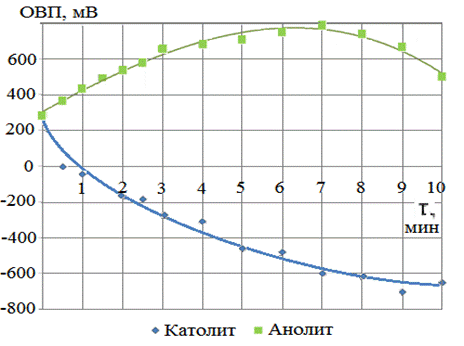
Длительность активации. Исходная водопроводная вода имела рН 7,92; ОВП 245 мВ. На рис. 2, 3 показано изменение рН и ОВП в зависимости от длительности электролизной активации. Установлено, что при увеличении длительности процесса электролиза от 1 до 10 минут величины рН полученных католита и анолита изменялись соответственно в диапазонах 9,3÷10,7 и 6,8 ÷ 3,0. При длительности электролиза до 7 мин значения ОВП изменялись закономерно: для католита снижались, для анолита увеличивались; однако при электролизе более 7 минут наблюдалось заметное уменьшение значений ОВП анолита и интенсивности снижения ОВП католита. Это позволило выбрать 7минут оптимальным временем для получения ЭХАВ на данном электролизёре. В последующих опытах использовалась вода, активированная в течение 7 минут.
|
|
|
Рис. 2 - Зависимость рН католита и анолита от длительности электролиза воды |
|
|
|
Рис. 3 - Зависимость ОВП католита и анолита от длительности электролиза воды |
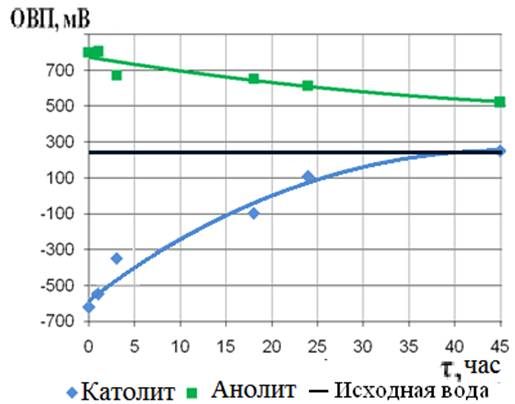
Исследование релаксационных процессов. Зависимость величин ОВП католита и анолита от времени их релаксации изучена в диапазоне от 30 мин до 45 часов (рис. 4). Как видно из рис. 4, при хранении католита в комнатных условиях в тёмной стеклянной бутыле, закрытой пластмассовой пробкой, в течение 45 часов показатель ОВП его изменился довольно значительно от отрицательной величины –600 мВ до + 200 мВ (∆ОВП ~ 800мВ). Отрицательные значения ОВП от –600 до –100 католит продолжал иметь в течение 17 часов его хранения; за ~ 40 часов величина его ОВП повысилась до уровня водопроводной воды. Для анолита наблюдалось медленное уменьшение величины ОВП от 800 до 500 мВ за 45 часов, далеко не достигая уровня водопроводной воды (245 мВ).
|
|
|
Рис. 4 - Релаксация ОВП ЭХАВ |
Величина рН католита резко снижалась в первые 48 часов, что может быть связано с поглощением углекислого газа воздуха, проникающего в бутыль через неплотности крышки. Значение рН 3 анолита сохранялось неизменным в течение двух и более месяцев (рис. 5). Из данных рис.4 и 5 видно, что католит релаксирует намного быстрее, чем анолит.
|
|
|
Рис. 5 - Релаксация рН ЭХАВ |
Экспериментальным обоснованием выявленного характера изменения величин ОВП воды в процессе её электролиза и последующей релаксации могут служить работы Пискарёва И.М. с соавторами [11-12]. В работе [11] было экспериментально установлено возникновение отрицательного ОВП (от –500 до –700мВ) в воде и в водных растворах солей при введении в них газообразного водорода. Важно отметить, что водород в воде лучше всего сохранялся в стеклянной посуде с металлической крышкой. В пластмассовых бутылях наблюдалось уменьшение содержания водорода и его практически полное исчезновение при хранении более 2 недель; это приводило к возрастанию ОВП через 2 недели до уровня, характерного для исходной воды. Вместе с этим в открытой посуде ОВП сохранялся отрицательным в течение только двух дней [12]. Для более длительного сохранения ОВП и рН ЭХА воды следует использовать стеклянную посуду и металлические крышки.
Результаты исследования влияния длительности электролиза воды и последующей релаксации на рН и ОВП католита и анолита [14]:
1.1.Установлено, что при электролизе воды в аппарате «Мелеста-М» в течение 10 минут, католит изменяет рН от 7,92 (исходная вода) до 10,7; ОВП от +245мВ (исходная вода) до –700мВ, а анолит соответственно рН до 3, ОВП до +500мВ.
1.2.На основе полученных графических зависимостей величин рН и ОВП католита и анолита от длительности электролиза воды в данном аппарате выявлен оптимальный период ЭХА 7 минут. При этом ОВП католита достигает – 600мВ и рН10, анолит имеет ОВП +800мВ и рН 4. Более значительные изменения ОВП отмечены в течение первых 3 минут.
1.3.Наибольшая неравновесность с более интенсивными релаксационными процессами характерна для католита, который приходит в равновесное исходное состояние по показателям рН и ОВП через двое суток. Анолит при хранении весьма медленно восстанавливает величину ОВП, а рН 3 остаётся практически неизменным 14 и более суток.
2. Исследование зависимости рН и ОВП католита и анолита от разбавления водой и соотношения их в бинарных смесях
Зависимость рН и ОВП бинарных смесей католита с анолитом от их состава. Исследования проводились на свежеприготовленных образцах ЭХАВ, полученных при 7-минутном времени электролиза, что экспериментально обосновано нами выше. При этом для католита величина ОВП составила – 600 мВ и рН 10,04, анолит имел ОВП +800 мВ и рН 4,05. Для исходной водопроводной воды ОВП = +200мВ и рН 8,01.
Католит и анолит, полученные электролизом водопроводной воды, можно классифицировать по величине рН, как принято для других водных растворов: рН 0-3 – сильнокислые среды; 3< рН < 7– слабокислые; рН 7 – нейтральная; 11> рН >7 – слабощелочные; рН 11-14 – сильнощелочные. С учётом данной классификации католит (рН 10,04), используемый в данной работе, относится к слабощелочной среде, анолит (рН 4,05) – к слабокислой.
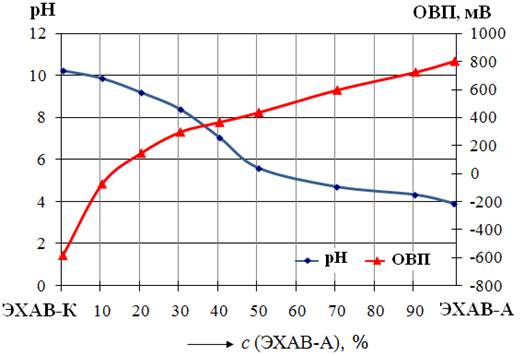
Измеренные значения рН и ОВП бинарных смесей католита с анолитом в зависимости от их состава представлены на рисунке 6 в виде диаграммы «свойство-состав, % об.».
|
Рис. 6- Диаграмма «рН, ОВП – состав» для бинарной смеси католита (ЭХАВ-К) и анолита (ЭХАВ-А) |
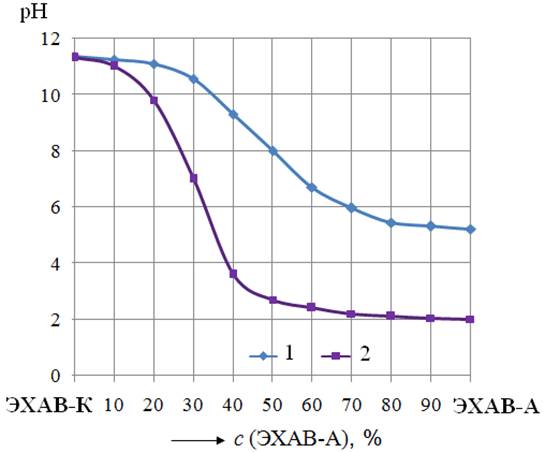
Как следует из рисунка 6, при добавлении анолита (ЭХАВ-А) к католиту (ЭХАВ-К) наблюдается неравномерный рост ОВП их смесей. Наиболее значительно (~35 мВ/%) ОВП повышается при увеличении содержания анолита до 20%, при концентрации анолита более 20% рост ОВП составляет всего ~9 мВ /%. Отрицательные значения ОВП имеют католит-анолитные смеси, содержащие 10% анолита и менее. ОВП нейтральной смеси католита с анолитом (рН 7) составляет около 250 мВ. Графическая зависимость рН от состава исследованных католит-анолитных смесей рН = ƒ (санолита , % об.) имеет слабо выраженный перегиб в области концентрации анолита близкой к 40 % (см. рис.6). Обнаруженная закономерность изменения рН католита (рН 10,04) при добавлении в него анолита (рН 4,05) согласуется с характером кривой титрования слабых кислот слабыми основаниями [ 9, с. 388] и подчиняется теории кислотно-основного титрования. Известно, что при титровании слабой кислоты слабым основанием (или наоборот), вследствие сужения интервала скачка рН в кислотной и щелочной областях, скачок рН на кривой титрования может исчезнуть. Анализ результатов подобных опытов Борисенко А.А., Шаманаевой Е.А., представленных, но не описанных ими в работе [13], показал, что при смешивании сильнощелочного католита (рН 11,10) и сильнокислого анолита (рН 2,06), наблюдается достаточно большой скачок рН (рис.7, кривая 2). При этом точка перегиба практически совпадает с точкой нейтрализации рН 7,00. Вследствие того, что концентрация ионов Н+ в использованном анолите на порядок была выше концентрации ОН– в католите, авторы работы [13] наблюдали нейтрализацию при 30%-ом содержании анолита в смеси. Для подтверждения сделанного нами вывода о согласовании характера графической зависимости рН = ƒ (санолита , % об.) с кривыми титрования разных по силе кислот и оснований был проведён специальный эксперимент с использованием смесей сильнощелочного католита (рН 11,35, рОН 2,65) со слабокислым анолитом (рН 5,21). Концентрация катионов Н+ в анолите была почти на 2 порядка меньше, чем содержание ОН– в католите. Построенная при этом кривая рН =
ƒ (санолита , % об.) приведена на рис.7 (см. график 1). Как следовало ожидать, интервал скачка рН на кривой 1 рис.7 выражен значительно слабее, чем на кривой 2. Точка эквивалентности находится в щелочной области выше точки нейтрализации. Для реакции нейтрализации потребовалось, как видно, более 50% анолита, в то время как в опыте Борисенко А.А., Шаманаевой Е.А. [13] с более кислым анолитом всего 30% (см. кривую 2 рис.7).
|
|
|
Рис. 7 - Диаграмма «рН – состав» для бинарных смесей католита (ЭХАВ-К) и анолита (ЭХАВ-А) с различными значениями рН исходного анолита: 1– данные авторов; 2– литературные данные [13]. |
Исходя из результатов проведенных исследований рН бинарных смесей католита с анолитом можно заключить, что характер графической зависимости рН = ƒ (санолита , % об.) согласуется с кривыми титрования разных по силе кислот и оснований.
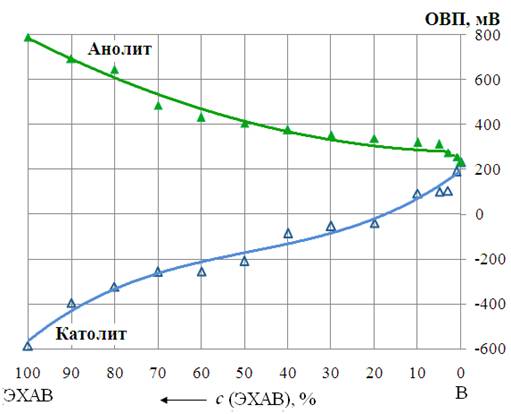
Зависимость рН и ОВП католита и анолита от степени разбавления их водопроводной водой. Закономерности изменения рН и ОВП католита и анолита при смешивании их с водопроводной водой показаны соответственно на рис. 8 и 9.
|
|
Рис. 8 - Диаграммы «рН–состав» для систем: католит-В, анолит-В (В–водопроводная вода) |
|
|
Рис. 9- Диаграммы «ОВП–состав» для систем: католит-В, анолит-В (В–водопроводная вода) |
Как видно из рис. 8, графическая зависимость рН смесей католита и анолита с водопроводной водой от состава близка к линейной. Добавление кислого анолита (рН 4,05) и щелочного католита (рН 10,04) к слабощелочной водопроводной воде (рН 8,01) способствует соответственно почти пропорциональному снижению в первом случае и повышению во втором рН их смесей. Установленные закономерности изменения рН позволяют, зная рН католита, анолита и водопроводной воды, по правилу аддитивности приближённо рассчитать, какого состава электрохимически активированный водный раствор надо приготовить, чтобы обеспечить заданную величину его рН. Аналогично можно приближённо рассчитать, какую величину рН будут иметь водные растворы католита и анолита заданного состава.
На рис.9 показано, что величина ОВП водопроводной воды (ОВП=200 мВ) закономерно снижается при прибавлении католита (ОВП = –600 мВ) и повышается при добавлении анолита (ОВП=800мВ). Достаточно добавить к воде 20% католита, чтобы получить активированный водный раствор с отрицательным значением ОВП = –50 мВ. 50%-ый водный раствор католита имеет ОВП= –170мВ, однако, при такой же концентрации анолита ОВП его водного раствора составляет +410мВ. Более значительное изменение ОВП водных растворов католита и анолита происходит, когда в растворе преобладает ЭХАВ. Экспериментально полученные графические зависимости «рН, ОВП-состав», представленные на рисунках 6–9 могут служить для научного обоснования и практического применения при получении электрохимически активированных водных растворов с заданными значениями рН и ОВП.
Выводы из результатов зависимости рН и ОВП католита и анолита от разбавления водой и соотношения их в бинарных смесях
2.1. С целью прогнозирования свойств и выявления более рациональных и экономичных условий применения католита, анолита, их двойных смесей и водных растворов для этих систем построены диаграммы «рН, ОВП–состав».
2.2. Впервые обнаружено, что для бинарных растворов католита с анолитом характер графической зависимости их рН от концентрации анолита согласуется с кривыми титрования разных по силе кислот и оснований и зависит от исходных концентраций анионов ОН– в католите и катионов Н+ в анолите.
2.3. Показано, что графическая зависимость рН католита (рН 10,04) и анолита (рН 4,05) от их разбавления водопроводной водой (рН 8,01) близка к линейной.
2.4. Установлено, что величина ОВП католита (–600 мВ) наиболее чувствительна к присутствию в нём анолита (ОВП= +800мВ) и мало изменяется при разбавлении его водопроводной водой (ОВП= +200мВ). Отрицательные значения ОВП имеют щелочные смеси католита с анолитом (рН 9,95 – 10,04), содержащие не более 10% анолита. Для получения электрохимически активированной воды (ОВП= – 50мВ) достаточно добавление католита к водопроводной воде до 20%-ой концентрации.
3.Исследование воздействия ЭХАВ-католита на биологические системы 3.1. Воздействие католита на рост водорослей Scenedesmus quadricauda (Turp.) Breb. и жизнеспособность Daphnia magna Straus
Постановка опытов показана на рисунке 10.
|
|
|
Рис. 10 – Постановка опыта по проведению биотестирования различных концентраций католита на Scenedesmus quadricauda |
Исследование воздействия католита на жизнеспособность Daphnia magna Straus двустворчатых низших ракообразных отряда ветвистоусых проводилось по методике Федерального Реестра 1.39.2001.00283. Опыт показал, что тестируемый раствор католита, даже без разбавления, не оказал острого токсического действия на многоклеточные организмы – дафнии и безопасен на организменном уровне.
Биотестирование с помощью водорослей Scenedesmus quadricauda (Turp.) Breb. (Сценедесмус четыреххвостный) проводили по методике Федерального Реестра 1.39.2001.00284. Контролем служила дистиллированная вода. Биотестирование с использованием водорослей позволило выявить влияние не только на уровне организма, но и популяции. Критерием токсичности являлось достоверное снижение прироста клеток по сравнению с контролем. Установлено, что при небольшим содержании католита (от 2% до
8 %) происходит стимуляция роста клеток сценедесмуса. При этом наибольший прирост по сравнению с контролем 27,4% имел место в варианте, содержащем 2% католита. Прирост клеток не превышал 30%, размеры и окраска клеток, структура расположения ценобий не отличались от контроля. Это позволило судить об отсутствии острого токсического действия раствора на культуру водорослей. Однако в вариантах с содержанием католита 30% и 50% наблюдалось снижение численности водорослей по сравнению с контрольным вариантом. В результате данной работы установлены экологически безопасные концентрации водного раствора католита, как для многоклеточных, так и для одноклеточных организмов. При этом показано, что культура одноклеточной водоросли Scenedesmus quadricauda является более чувствительным тест-объектом по отношению к католиту, чем многоклеточные дафнии.
3.2.Влияние католита на некорневую подкормку растений озимой пшеницы
В работе [15] нами предложен состав комплексного минерального удобрения, содержащего макроэлементы: Р, N, К, Са, и микроэлементы B, Mn, Cu, Mo, Fe, K, Zn, Ni, I, Co, S, Al, Sn в специально подобранных концентрациях с учётом химического состава зерна пшеницы [16], для обработки в фазу кущения вегетирующих растений озимой пшеницы. Новизна работы [15] подтверждена патентом РФ [17]. Данный состав некорневой подкормки позволяет обеспечить растения пшеницы питательными элементами, необходимыми для формирования растительных клеток в пропорциях, соответствующих элементному составу зерна. В результате полевых испытаний разработанного состава минерального удобрения получено увеличение урожайности озимой пшеницы более чем на 0,45 т/га [15].
Для повышения усвояемости микроэлементов растениями озимой пшеницы нами впервые рекомендовано применение в качестве растворителя удобрений 20 %-го раствора католита в водопроводной воде [4]. До настоящего времени данные об использовании электроактивированной воды в некорневой подкормке пшеницы в литературе отсутствовали. Применение электроактивированной воды было запатентовано только для предпосевной обработки семян озимой пшеницы [18]. Выбор 20 %-ой концентрации католита в водопроводной воде основан на результатах экспериментальных данных по влиянию концентрации католита на всхожесть семян пшеницы и биотестированию. Приготовление питательного раствора комплексного минерального удобрения осуществлялось по методике, описанной в работе [19]. Минерализация раствора с макроэлементами составляла 1,25 г/л (0,0125 %).
Полевые испытания. Изучение влияния разработанных некорневых подкормок на продуктивность озимой пшеницы сорта Дельта проводилось в течение 3 лет на опытном поле учебного хозяйства «Кубань» Кубанского ГАУ. В ходе опыта посевы озимой пшеницы обрабатывались в фазу кущения (весной) раствором макро- и микроэлементов, приготовленном на дистиллированной и ЭХА воде. Контролем служили делянки, обработанные водопроводной водой.
Схема опыта:
1. Контроль.
2. Раствор разработанного комплексного удобрения с общей концентрацией растворенных химических веществ 1,92 г/л.
3. Раствор удобрений (идентичных варианту 2) c использованием в качестве растворителя – смеси электроактивированной воды (католита) с водопроводной в соотношении 1:5 (рН 8÷ 9).
Растения обрабатывали с помощью ранцевого опрыскивателя. Общая площадь делянки – 30 м2, учётная – 20 м2. Расход водного раствора 300 л/га. Повторность опыта четырёхкратная, размещение систематическое. В опыте применялась агротехника выращивания озимой пшеницы, рекомендованная для условий центральной зоны Краснодарского края, с учетом предшествующей культуры – кукурузы на зерно. Норма высева – 5 млн. всхожих семян на 1га. Учёт и наблюдения в опыте проводились по методике государственного сортоиспытания. Погодные условия в годы проведения опыта сложились благоприятно для роста и развития озимой пшеницы. Влияние некорневых подкормок на элементы структуры урожая озимой пшеницы приведено в таблице 1.
Таблица 1 – Влияние некорневых подкормок на элементы структуры урожая озимой пшеницы
|
Вариант |
Количество продуктивных |
Длина колоса, см |
Число зёрен в колосе, шт. |
Масса 1000 зёрен, г |
Масса зерна с колоса, г |
|
|
стеблей, шт./м2 |
колосков в колосе, шт. |
|||||
|
1 (Контроль) |
501 |
15,3 |
7,7 |
28,2 |
39,3 |
1,11 |
|
2
|
511 |
16,1 |
7,8 |
28,7 |
40,8 |
1,17 |
|
3
|
530 |
16,7 |
8,1 |
29,5 |
42,0 |
1,24 |
Применение разработанного нами комплексного удобрения со специальным составом микроэлементов оказало положительное влияние на листовую поверхность (растения и посева), а также на продолжительность функционирования листьев, накопление наземной биомассы, общую и продуктивную кустистость. Обработанные растения имели большую вегетативную массу, площадь листьев, отличающихся более интенсивной окраской, количеством продуктивных стеблей по сравнению с контролем, что в значительной степени оказало влияние на урожайность озимой пшеницы (таблица 2).
Таблица 2 – Влияние разработанных некорневых подкормок на урожайность зерна озимой пшеницы
|
Варианты |
Урожайность, т/га |
Прибавка к контролю |
|
|
т/га |
% |
||
|
1 |
5,34 |
- |
- |
|
2 |
5,79 |
0,45 |
8,4 |
|
3 |
6,01 |
0,67 |
12,5 |
|
НСР 05 |
0,14 |
||
В среднем за 3 года проведения полевых опытов было однозначно установлено положительное воздействие ЭХАВ-католита в качестве растворителя специально разработанных некорневых подкормок на урожайность зерна озимой пшеницы.
Применение нового комплексного минерального удобрения в специально подобранных концентрациях с учётом химического состава зерна (вариант 2) позволило получить прибавку урожайности 0,45 т/га (8,4 %). Использование в качестве растворителя предложенного состава некорневой подкормки 20 % -го раствора католита обеспечило увеличение урожайности озимой пшеницы по сравнению с контролем на 0,67 т/га, что составило 12,5 % (вариант 3). Качество зерна озимой пшеницы в проведенных опытах при применении некорневых подкормок в фазу кущения незначительно отличалось от контроля и соответствовало требованиям зерна 4 класса (продовольственное).
На основе полевых опытов по совершенствованию технологии некорневой подкормки растений сельскохозяйственных культур:
3.1. Впервые предложено для комплексной некорневой подкормки растений озимой пшеницы, содержащей микроэлементы в специально подобранных концентрациях с учётом элементного состава зерна, использовать в качестве растворителя 20%-ый раствор электроактивированой воды (католита).
3.2. Обработка вегетирующих растений озимой пшеницы сорта Дельта в фазу кущения весной удобрением, растворённым в 20 %-омводном растворе католита, позволила получить увеличение урожайности зерна на 12,5 % при сохранении его качества.
3.2.1. О механизме воздействия некорневой подкормки растений пшеницы с применением ЭХАВ
Выявленная биологическая активность ЭХАВ-католита в качестве растворителя удобрений позволяет рассматривать его как самостоятельный биоростостимулятор. Следует отметить, что католит предложен нами не только для получения оптимального рН питательной среды, а как донор электронов. Это воздействие невозможно достичь корневой системой внесения удобрений, а эффективно лишь в случае некорневой подкормки.
. При этом биологическое действие католита (концентрата ОН–-групп) сводится к улучшению фотосинтеза и связана с его электронодонорной способностью, с переводом растворённого кислорода в активированное состояние О2– и анитиоксидантной активностью, стимулирующей тканевое дыхание, физиологическую регенерацию, активность ферментов. Роль католита не только в наличии свободных ОН–-групп, но и в повышенном энергетическом состоянии его за счёт восстановительных свойств, т.е. в способности поставлять электроны растению. Анализ ОВР с участием ОН–, происходящих при фотосинтезе, показал их соответствие ОВР в католите. Это сходство доказывает непосредственную биологическую энергетическую роль католита в фотосинтезе при некорневом стимулирующем воздействии его на обрабатываемые растения. Таким образом, ЭХАВ – католит, используемый в качестве растворителя микро- и макроэлементов, является самостоятельным биостимулятором, улучшающим фотосинтез. Следует отметить, что фотосинтез поставляет растению первичные органические соединения и таким образом влияет на накопление массы растения. Однако депрессия фотосинтеза часто связана с нарушением оттока ассимилятов из листа к нефотосинтезирующим органам, например плодам. Накопление в хлоропласте продуктов фотосинтеза, происходящее в результате нарушения процессов оттока, приводит к торможению действия ряда ферментов. Поэтому католит, обладающий восстановительными свойствами, улучшает фотосинтез и обмен веществ. В процессе фотосинтеза кванты света взаимодействуют с молекулами хлорофилла, в результате чего эти молекулы, точнее их электроны переходят в более высокоэнергетическое состояние. Избыточная энергия части молекул передаётся ионам водорода и гидроксила, присутствующих в воде. Ионы гидроксила ОН– отдают свои электроны другим молекулам и превращаются в свободные радикалы ОН. Радикалы ОН взаимодействуют друг с другом, в результате чего образуется вода и молекулярный кислород в соответствии с уравнением:
4 ОН →2 Н2О + О2
Приведенные окислительно-восстановительные процессы с участием ионов гидроксила ОН–, происходящие при фотосинтезе, аналогичны процессам в католите. Это сходство может служить дополнительным доказательством непосредственной биологической энергетической роли католита в фотосинтезе и некорневом стимулирующем воздействии на растения.
4. О механизме электрохимической активации (ЭХА) воды
Электролизная активация воды, на наш взгляд, осуществляется на электромагнитном энергетическом уровне за счёт воздействия электрического (между электродами электролизёра) и фотонного электромагнитного (ЭМ) полей [7]. Фотонное поле имеется вокруг каждой заряженной частицы. Свободные фотоны проявляют себя как носители тепловой энергии и энергии ЭМ-излучения. Молекулы воды обладают дипольным электрическим моментом, изменяющимся по гармоническому закону р = роcos(ωt), что связано с синхронным вращением валентных электронов атомов водорода и кислорода с угловой частотой ω ≈ 1016 рад/с. Под действием высокой напряженности электрического поля вблизи электродов происходит разрыв молекул воды на ионы ОН– и Н+ (протоны р). Протоны, образующиеся при диссоциации воды в электролизёре, обладают избытком фотонной энергии. При этом внешние фотоны их ЭМ поля будут излучаться в виде ЭМ волн ультрафиолетового спектра (1015 ÷1017 Гц), который характерен для колебаний атомов в молекуле Н2О. Фронт этих электромагнитных стоячих волн распространяется в пространстве между электродами и приходит в контакт с молекулами воды. При этом увеличивается амплитуда колебаний атомов в молекулах H2O за счёт явления резонанса при равенстве собственной частоты колебаний атомов частоте воздействующих фотонов. Это способствует уменьшению энергии химической связи молекул H2O и их диссоциации с образованием ОН– и Н3О+. Кроме этого протонами могут излучаться фотоны рентгеновского и мягкого гамма-спектра. Это излучение вызывает радиолиз воды, сопровождающийся ионизацией (отрывом е–) и возбуждением молекул, что приводит к образованию свободных атомов и радикалов ( Н* , ОН* , О* ), а также различных продуктов их взаимодействия. Воздействие ЭМ поля впервые рассмотрено с позиций новых представлений о модели фотона как электрической дипольной частицы, движение которой описывается уравнением стоячей волны [20].
Механизм электрохимической активации (ЭХА) воды включает следующие этапы:
4.1.При электролизе воды под действием высокой напряжённости электрического поля вблизи электродов происходит разрыв молекул воды на ионы ОН– и Н+ .
4.2. Образующиеся катионы водорода представляют собой протоны – ядерные частицы, обладающие большим избытком фотонной энергии. При этом внешние фотоны их электромагнитного поля будут излучаться в виде ЭМ волн ультрафиолетового спектра ( 1015 ÷ 1017 Гц), который характерен для колебаний атомов в молекуле Н2О.
4.3.Фронт этих ЭМ стоячих волн распространяется в пространстве между электродами, и пронизывая герметичную капсулу ( в случае бесконтактной активации), приходит в контакт с молекулами воды.
4.4.За счёт явления резонанса при равенстве собственной частоты колебаний атомов Н2О частоте воздействующих фотонов увеличивается амплитуда колебаний атомов в молекулах воды. Это способствует разрушению химической связи молекул воды и их диссоциации.
4.5.Фотонное поле способствует возбуждению и ионизации молекул воды, которая заключается в отрыве электронов.
4.6.Свободные электроны и электроны на носителях, например ОН– , способны участвовать в окислительно-восстановительных процессах и обеспечивают отрицательные значения ОВП католита.
4.7.Окислительно-восстановительные реакции, происходящие в ЭХАВ, приводят к образованию весьма активных частиц ( в том числе и радикалов), а также перераспределению зарядов между ними.
Образующиеся в результате дополнительной диссоциации молекул воды ОН– являются донорами электронов, без которых невозможны основные жизненные процессы – дыхание, обмен веществ. Поэтому характерными свойствами католита (концентрата ОН–-групп) являются отрицательные значения ОВП, антиоксидантная активность, интенсификация фотосинтеза, ростостимулирующая способность. Анализ ОВР с участием ОН–, происходящих при фотосинтезе, показал их соответствие ОВР в католите и позволил объяснить положительное влияние последнего в некорневой подкормке растений.
Литература
1. Зайцев, И.Д. Применение и познание временно активированной воды/ И.Д. Зайцев, Э.И. Креч// Химическая промышленность, 1989.- №4.- с. 44-47.
2. Бахир, В.М. Электрохимическая активация/ В.М. Бахир.- М.: ВНИИИМТ НПО "ЭКРАН",1992.- ч.1. - 401 с. . Бахир В.М., Электрохимическая активация: универсальный инструмент зеленой химии/ В.М.Бахир. – Казань: Маркетинг саппорт сервиз, – 2005. – 176с.
3.Шрамко Г.А., Александрова Э.А., Князева Т.В. Совершенствование технологии некорневой подкормки озимой пшеницы с применением электрохимически активированной воды // Научный журнал Труды Кубанского государственного аграрного университета. – 2011 г. –№6 (33), С. 69–72.
4. Александрова Э.А., Гергаулова Р.М, Шрамко Г.А., Шишкова О.С. Способ некорневой подкормки озимой пшеницы Патент на изобретение №2349072.. Опубликовано 20.03.2009. Бюл. № 8.
5. Александрова Э.А., Дорошенко Т.Н., Гергаулова Р.М. Шрамко Г.А. Способ некорневой подкормки плодовых семечковых культур, Патент на изобретение №2355160, Опубликовано 20.05.2009. Бюл. № 14.
6. Electrolysis: Obtaining hydrogen from water: The Basis for a Solar-Hydrogen Economy// Электронный ресурс: http//www.nmsea.org /Curriculum/7_12/electrolysis /electrolysis.htm.
7. Александрова, Э.А. Роль электромагнитного поля в электрохимической активации воды/Э.А.Александрова, Б.Л.Александров, Г.А. Шрамко // Слабые и сверхслабые поля и излучения в биологии и медицине. Тезисы V международного конгресса.- С.-П., 2009.-с. 35.
8. Сборник методик и инструктивных материалов по определению вредных веществ для контроля источников загрязнения окружающей среды, часть 2. Инструкция по отбору проб для анализа сточных вод НВН 33-5.3.01-85. Краснодар: «Северный Кавказ», 1993.- 222 с.
9. Александрова, Э.А. Аналитическая химия. Теоретические основы и лабораторный практикум. В двух книгах. Книга 1. Химические методы анализа/ Э.А.Александрова, Н.Г. Гайдукова// – М.: Колос, 2011. – 549 с.
10. Александрова, Э.А. Аналитическая химия. Теоретические основы и лабораторный практикум. В двух книгах. Книга 2. Физико-химические методы анализа/ Э.А.Александрова, Н.Г. Гайдукова// – М.: Колос, 2011. – 351с.
11. Пискарев, И.М. Окислительно-восстановительный потенциал воды, насыщенной водородом/ И.М. Пискарев, В.А.Ушканов, П.П. Лихачев, Т.С. Мысливец// Электронный журнал "Исследовано в России" // С. 230-239
12. Пискарев, И.М. Релаксация окислительно-восстановительного потенциала жидкости, насыщенной водородом/ И.М. Пискарев, В.А. Ушканов// Электронный научный журнал «Исследовано в России»// – С. 1141-1150.
13. Борисенко А.А., Шаманаева Е.А. «Исследование изменения рН и ОВП среды посредством смешения кислой и щелочной фракций электроактивированной воды», Вестник СевКав ГТУ «Продовольствие»№1 (7), 2004.
14. Шрамко Г.А., Александрова Э.А., Красавцев Б.Е., Цатурян, А.С., Симкин В.Б.
Влияние длительности электролиза воды и последующей релаксации на электрохимические
характеристики католита и и анолита // Научный журнал Труды Кубанского
государственного аграрного университета.– 2012 г. – № 2 (35).
15. Александрова Э.А., Шрамко Г.А., Князева Т.В. Новый состав минеральных удобрений для некорневой подкормки озимой пшеницы // Научный журнал Труды Кубанского государственного аграрного университета. – 2010 г. – №1(22), С. 71–74.
16. Химический состав пищевых продуктов/ Под редакцией М.Ф. Нестериной, И.М. и Скурихиной – М.: Пищевая промышленность, 1979. – 140 с.
17. Александрова Э.А, Гергаулова Р.М, Шрамко Г.М, Князева Т.В., Способ обработки озимой пшеницы. Патент на изобретение №2349071. Опубликовано 20.03.2009 Бюл. № 8.
18. Ахметов Р.Р., Гилязетдинов Ш.Я., Яхин И.А., Рамазанов Н.Г., Вахитов В.А., Нусратуллини Р.Ф. Способ обработки злаковых культур. Авторское свидетельство № 946484,
А 01 N 59/06. Опубликовано 30.07.82, Бюл.№28.
19. Агрохимия / Под ред. Б.А. Ягодина. – М.: ВО Агропромиздат, 1989. – 584 с.
20.Александров Б.Л., Родченко М.Б., Александров А.Б. Роль фотонов в физических и химических явлениях. Краснодар, Изд-во «Печатный двор Кубани», 2002 г., 543с.
EFFECT OF ELECTROCHEMICALLY ACTIVATED WATER ON THE PLANT BIOSYSTEMS
E.A.Alexandrova, G.A.Shramko. B.E.Krasavtsev
Kuban State Agrorian University, 350044 Krasnodar, 13 Kalinin str., alex2e@yandex.ru