Адрес этой статьи в интернете: www.biophys.ru/archive/congress2012/proc-p118-d.htm
ВОЗМОЖНАЯ РОЛЬ РЕСТРУКТУРИЗАЦИИ ВОДЫ В СЛАБЫХ ЭЛЕКТРИЧЕСКИХ ПОЛЯХ ПРИ ЭЛЕКТРОАДАПТАЦИИ МИКРООРГАНИЗМОВ К СТРЕССОВЫМ ВОЗДЕЙСТВИЯМ
Андреев В.С.
Учреждение ООО «ЭлектроЭкоТехнологии»,
195027, Россия, Санкт-Петербург, Среднеохтинский проспект 2А-2, E-mail: office@elecotec.com
В свое время, нами был обнаружен феномен существенного повышения устойчивости микроорганизмов к самым различным видам стресса как в результате предварительной экспозиции клеток во внешних электрических полях низкой напряженности, так и под воздействием полей, которые возникают в микробных популяциях в результате суперпозиции локальных градиентов электрического напряжения, обусловленных наличием межфазных двойных электрических слоев вблизи поверхностей микробных клеток .
В дальнейшем эти эффекты, которые можно наблюдать при электрических воздействиях на микроорганизмы, принадлежащие совершенно различным таксономическим группам, побудили нас к более углубленному изучению процессов, лежащих в их основе, что, в итоге, позволило сформулировать концепцию «электробиохимического механизма адаптации микроорганизмов к стрессу».
Вкратце напомним суть основных экспериментов, позволивших нам прийти к выводу, что именно усиление электрического поля, воспринимаемого (детектируемого) цитоплазматическими мембранами, предупреждает микробные клетки о развитии неблагоприятной ситуации. При этом увеличение напряженности электрического поля является тем универсальным кодом, который микроорганизмы используют для передачи информации о надвигающемся стрессе на популяционном уровне.
Во избежание действия побочных факторов на результаты экспериментов, опыты проводились с использованием трехкамерных электрохимических ячеек, в анодной и катодной камерах которого циркулировал раствор фосфатного буфера, а микробная культура находилась в центральной камере отделенной от крайних полупроницаемыми полимерными мембранами (рис.1).
|
|
|
Рис.1. Схема установки для электрообработки микроорганизмов в условиях, максимально приближенных к оптимальным для развития микробной популяции |
Обозначения на схеме:1-корпус, 2,3-электродные камеры, 4,5-электроды, 6-рабочая камера, 7-полупроницаемые мембраны, 8-пористые прокладки, 9,10-гранулы сорбента и фильтры (в случае проточного культивирования микробных клеток), 11-насос для прокачки буферных растворов через электродные камеры, 12-емкость для питательной среды, 13-насос для прокачки культуральной среды через рабочую камеру, 14-компрессор для аэрации питательной среды, 15-влагосборник, 16-ротаметр для контроля расхода воздуха, 17, 18- оптические детекторы, 19,20, 21-кондуктометрический и др. детекторы, 22-сосуд для сбора отработанной среды, 23-газосборник для нормальной работы проточных детекторов, 24-воздушные фильтры, 25-регулируемый блок электропитания, 26-модулятор потока для интенсификации массообменных процессов, 27-вольтметр, 28-амперметр.
В первой серии экспериментов, выполненных на клетках Е. coli М-17 [1] после 10... 20-минутных экспозиций в постоянных полях напряженностью (1...3)·103 В/м обнаруживался эффект повышения устойчивости клеток к ряду антибиотиков, а также к лизоциму, ЭДТА, дезоксихолату натрия, додецилсульфату натрия (ДДС) и другим детергентам (рис. 2).
|
|
|
Рис.2. Кривые лизиса клеток E. coli M-17 ДДС до (1) и после (2) обработки в электрическом поле |
Этот эффект свидетельствует о том, что бактериальные оболочки под воздействием поля становились менее проницаемыми для перечисленных веществ. При этом увеличивались ζ-потенциал клеток и резистентность бактерий к гиперосмотическим шоковым воздействиям и. Указанные эффекты имели длительное последействие.
Электронно-микроскопические исследования выявили некоторые изменения нуклеоидов микробных клеток, которые после воздействия поля более или менее дисперсно распределялись по цитоплазме, что, впрочем, иногда наблюдается у клеток и в обычных условиях и зависит от особенностей режима культивирования.
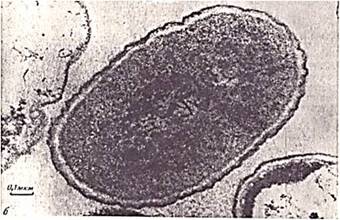
Учитывая чрезвычайно слабое непосредственное действие поля на нуклеоид, имеющий фактически двойную экранировку - изолирующей клеточной стенкой и проводящей цитоплазмой (см. также рис.5), следует принять механизм влияния поля на нуклеоид, опосредованный через цепь процессов с начальными звеньями, локализованными в периферических областях клеток. Под действием поля происходило также уменьшение размеров клеток, некоторое округление последних и изменение характера распределения рибосом в цитоплазме. Наружные мембраны клеток приобретали более четкую двухконтурную структуру и снаружи от них появлялось больше электронно-плотного (при контрастировании) дискретного материала (рис. 3).
|
|
|
|
Рис.3. Электронные микрофотографии ультратонких срезов клетки E.coli M- 17 при увел. 84 000 а – до воздействия электрическим полем; б-после воздействия электрическим полем |
|
В табл. 1 представлены результаты измерений ζ-потенциала клеток Е. coli М-17 и S. marcescens В10М-1 после их экспозиции в постоянных электрических полях различной напряженности (Е). Измерения проводились по классической методике [2] при 600 В/м. Перед экспозицией культуры центрифугировались при 3000 об/мин и ресуспендировались в 0,15 М растворе NaCl.
Таблица 1
Влияние электрических полей
различной напряженности на среднюю величину ζ-потенциала (![]() ) микробных клеток
) микробных клеток
|
Вид микроорганизма |
Контроль (E=0) |
E=103 В/м |
E= 3∙103 В/м |
E= 5∙103 В/м |
|
Время экспозиции 10 мин |
||||
|
Е. coli М-17 |
22,3±0,7 |
23,8±0,7 |
25,0±0,8 |
24,0±0,7 |
|
S. marcescens |
21,8±0,7 |
23,1±0,8 |
24,3±0,8 |
23,3±0,8 |
|
Время экспозиции 20 мин |
||||
|
Е. coli М-17 |
22,3±0,7 |
25,7±0,8 |
26,9±0,8 |
25,8±0,7 |
|
S. marcescens |
21,8±0,7 |
24,0±0,8 |
26,0±0,8 |
24,5±0,7 |
Еще больший эффект увеличения электрокинетического потенциала после электрообработки наблюдался у клеток Е. coli М-17, ресуспендированных в 0,05 М растворе NaCl (табл. 2).
Таблица 2
Влияние электрических полей
различной напряженности при различном времени экспозиции (t) на среднюю величину ζ -потенциала (![]() ) клеток E. coli M-17
) клеток E. coli M-17
|
t, мин |
Контроль (E=0) |
E=103 В/м |
E= 3∙103 В/м |
E= 5∙103 В/м |
|
10 |
27,4±0,8 |
33,2±0,8 |
37,8±0,9 |
46,2±0,9 |
|
20 |
27,4±0,8 |
39,1±0,9 |
44,7±0,9 |
49,1±1,0 |
|
30 |
27,4±0,8 |
40,1±0,9 |
35,0±0,8 |
30,2±0,8 |
Из таблиц видно, что ζ-потенциал возрастает с увеличением напряженности поля и времени экспозиции.
Обнаруженный эффект был подтвержден исследованиями Л.А. Кульского с соавт. [3], который, обрабатывая в течение 30 мин суспензии Е. coli при напряженности (2,5... 10,0) ·102 В/м, наблюдал возрастание ζ-потенциала по абсолютной величине от -37,1 до -56,2 мВ. Правда, авторы цитируемой работы акцентировали внимание не на указанном явлении, а на констатации эффектов влияния различных катионов на электроповерхностные свойства микроорганизмов и взаимосвязи между значениями ζ-потенциала и их жизнедеятельностью. Эти исследования позволили авторам расположить катионы но их антимикробному действию в следующий ряд: Ag+>Cu2+>Al3+≥Fe3+≥La3+≥Th3+/4+. Бактерицидное действие усиливалось в электрическом поле только в случае катионов Ag+ и Сu2+, при этом обнаруживалась сильная зависимость эффекта от напряженности внешнего поля. На основании того, что с повышением напряженности электрического поля, так же как и с увеличением концентрации электролита, электрокинетический потенциал клеток повышается, авторы делают вывод в пользу механизма изменения поверхностной адсорбции ионов. При этом предполагается, что наложение электрического поля как энергетического фактора способствует процессу переноса ионов в микробную клетку.
Нам представляется более убедительной другая группа выводов авторов, согласно которой имеются две стадии процесса воздействия катионов тяжелых металлов на живые микроорганизмы. На первой - происходит так называемая биохимическая сорбция, сопровождающаяся связыванием ионов при параллельном возрастании ζ-потенциала. На второй - имеет место классическая адсорбция катионов на отрицательно заряженных группах клеточной поверхности с частичной нейтрализацией заряда последней. Тот факт, что процесс связывания катионов тяжелых металлов убитыми микроорганизмами выявляет только вторую стадию, бесспорно, свидетельствует о роли биохимических (точнее, как нам кажется, физиологических) механизмов.
Важные детали биофизического механизма рассмотренного выше эффекта увеличения ζ-потенциала бактерий при электрообработке становятся понятными из результатов электронно-микроскопических (см. рис. 2), кондуктометрических и спектронефелометрических исследований [1, 4]. Эти исследования показали, что при помещении бактерий в электростатические поля напряженностью порядка 103 В/м происходит уменьшение их размеров вследствие частичной дегидратации. Исходя из этого, наиболее вероятным механизмом, обусловливающим возрастание ζ-потенциала бактерий при электрообработке, представляется увеличение поверхностной плотности ионогенных групп внешней мембраны, главным образом за счет сокращения размеров клеток вследствие дегидратации. Заключение об уплотнении оболочечного комплекса при электрообработке позволяет дать объяснение и эффекту понижения чувствительности микробных клеток к действию некоторых химических агентов (ПАВ, ряда антибиотиков). Что касается причин сжатия клеток в поле, то, возможно, ключ к их пониманию следует искать в области электрострикционных явлений, изученных на примере бислойных липидных мембран.
Исходя из данного предположения, представляется возможным дать объяснение еще одному экспериментально обнаруженному факту, заключающемуся в различной степени электроадаптации микроорганизмов в зависимости от их вида и исходного состояния культуры. Как известно, липиды составляют 10—30% веса мембран, 40—70% веса приходится на долю белков [5]. При этом химический состав и структура мембран зависят от условий выращивания и хранения клеток [6]. Температура культивирования и состав питательной среды определяют состав жирных кислот у бактерий [7]. С другой стороны, как отмечалось выше, электроупругие свойства биомембран весьма чувствительны к перечисленным структурным факторам, что позволяет связать электрострикционные эффекты и, следовательно, эффективность электроадаптации с исходным состоянием культуры. Это, разумеется, не исключает роли процессов ауторегуляторного характера, которые могут запускаться одновременно с электромеханическими.
Частичное обезвоживание и сжатие клеток при электрообработке сопровождается повышением их дегидратационной устойчивости при последующих осмотических шоках. На рис. 4 приведены кинетические кривые переживания клетками различных культур гиперосмотического шока, создаваемого 1М раствором L-арабинозы для тестирования клеток на дегидратационную устойчивость. Оценка величины дегидратации микробных клеток (D) может быть выполнена на основе уравнения электропроводности разбавленной суспензии непроводящих сфероидных частиц, обладающих поверхностной проводимостью cs [1].
|
|
а – E.coli; б - S.marcescens; в - Micrococcus Lysodeicticus; г - Artrobacter sp.
1 - экспериментальные точки, полученные после электрообработки клеток; 2 – экспериментальные точки, полученные после электрообработки клеток
|
|
Рис.4. Кондуктограммы переживания клетками различных таксономических групп гиперосмотического шока (1М раствор L-арабинозы) до и после элетрообработки
|
|
Ход второй (восходящей) ветви кондуктограмм рис. 4 отражает процесс переживания клетками следствий их начальной дегидратации и также существенно зависит от исходного состояния культуры. Увеличение электропроводности на второй стадии коррелирует с выходом внутриклеточного содержимого, в том числе УФ-поглощающих веществ, вследствие нарушения барьерной функции внешних мембран [1].
Из рис. 4 видно, что электрообработка суспензий микроорганизмов различных таксономических групп влечет за собой уменьшение степени их дегидратации при гиперосмотическом шоке. На основании приведенных кондуктограмм можно было бы утверждать, что в результате воздействия электрического поля микробные клетки стали устойчивей к дегидратации. Однако следует помнить об уменьшении объема внутриклеточной воды при электрообработке. Вид кривых рис. 3, очевидно, обусловлен и этим фактором.
Ясность в рассматриваемый вопрос вносят результаты второй серии исследований, главной целью которой было установить, как сказывается обработка электрическим полем на выживаемости бактерий при обезвоживании и тепловом шоке [8]. Опыты проводили с культурами Е. coli М-17 и S. marcescens. Показано, что в результате действия поля клетки становятся значительно более устойчивыми не только к действию гиперосмотических сред, но и к некоторым видам высушивания (за исключением лиофильного), к аэрозолированию, а также к воздействию повышенных температур (45-55С°). В зависимости от времени экспозиции, напряженности поля и состояния исходной культуры эффект может достигать тысяч процентов, причем повышение жизнеспособности культур при стрессовых воздействиях после электрообработки оказывается тем значительнее, чем ниже резистентность исходной культуры. При этом повышенная жизнеспособность культур сохраняется в течение многих суток.
Таким образом, имеются все основания говорить об электроадаптации бактерий к стрессовым факторам. Феномен электроадаптации бактерий имеет, на наш взгляд, важное теоретическое и практическое значение, по крайней мере, в тех областях технической микробиологии, в которых конечной целью ставится получение максимального количества жизнеспособных клеток в препаратах, подвергаемых стрессу. В свете изложенных данных тест гиперосмотической резистентности микробных клеток, характеризуемой кондуктограммами рис. 4, приобретает значение теста на дегидратационную устойчивость микроорганизмов, что подтверждено большим статистическим материалом, полученным при сопоставлении данных методов кондуктометрии и подсчета колоний после высева бактериальных культур на плотные среды [1].
Исследуя механизм явления электроадаптации, мы обнаружили следующий весьма важный факт. Клетки бактерий, экспонированные в электрическом поле, не только приобретают новые свойства, но и выделяют в культуральную среду некий регуляторный фактор, способный сообщать нативным клеткам свойства экспонированных. Иными словами, когда нативные клетки переносятся в супернатант клеток из той же популяции, но обработанных полем, их устойчивость к обезвоживанию возрастает в несколько раз по сравнению с контролем. Показано, что фактор электрообработки не инактивируется протеолитическими ферментами, а также при нагреве до 80 °С и обладает достаточно универсальным действием. Будучи выделен из Е. coli М-17, например, он идентично действует на бактерии St. aureus 209, Enterobacter cloaceae, Klebsiela aerogenes, Pseudomonas maltophilia CCEB 715. Работы по его выделению, очистке и идентификации пока не завершены. На данном этапе можно считать, что указанный фактор отличается от так называемого d-фактора, который накапливается в культуральной среде в процессе нормальной жизнедеятельности микробной популяции [9]. В отличие от этого авторегуляторного фактора он не влияет на максимальную скорость роста бактериальных культур. Возможное влияние фактора электрообработки, назовем его EF-фактором (Electric Field Factor), на параметры роста бактерий мы изучали, выращивая клетки Е. coli М-17 в глюкозо-минеральной среде М-17 на качалке. В питательную среду вместе с посевным материалом вносили надосадочную жидкость от клеток той же культуры, ресуспендированных в 0,15 М растворе NaCl и экспонированных в электрическом поле напряженностью 103 В/м в течение 15 мин. В контрольные варианты вносили надосадочную жидкость от клеток, не подвергавшихся действию поля.
Кривые роста бактерий опытного и контрольного вариантов не отличались в лаг-фазе и на стадии экспоненциального роста. В стационарной же фазе и особенно на стадии отмирания наблюдались различия, выражавшиеся в том, что когда количество способных к делению клеток в контрольных пробах начинало снижаться, клетки с добавлением фактора элетрообработки продолжали расти. Характерно, что сами клетки, подвергнутые электрообработке, демонстрируют аналогичную нечувствительность к веществам, угнетающим рост в стационарной фазе, но таким клеткам свойственно увеличение продолжительности лаг-периода при сохранении скорости роста в экспоненциальной фазе на том же уровне, что и у контрольных клеток. Снижение чувствительности электрообработанных клеток к аутоингибирующим факторам отвечает уже отмечавшейся выше общей тенденции повышения резистентности бактерий к действию ряда неблагоприятных химических агентов.
Задаваясь вопросом, почему адаптация микробных клеток к электрическому воздействию (по существу, к электрошоку) одновременно является и адаптацией их к обезвоживанию при сушке и осмотических шоках, а также к термошоку, т. е. процессам самой различной природы, мы увидели несомненные электрические эффекты, кроющиеся за каждым из названных воздействий. Анализ указанных процессов на базе модели, представленной на рис. 5, позволил предложить рабочую гипотезу, с наибольшей вероятностью, на наш взгляд, объясняющую сегодня механизм электроадаптации микроорганизмов к стрессам за счет адаптации к «электрошоку», сопровождающему каждый из рассмотренных видов стресса. Модель клетки рис.5 является статической и поэтому весьма условна в случае подвижных микробных клеток. В реальности, в силу броуновского движения и различных видов таксиса клетка подвергает свои инфраструктуры воздействию сил электрического поля под изменяющимися углами и фактически переменных. Она строга в случае неподвижной клетки в поле электрических сил. Но по мере повышения ионной силы культуральной среды поверхность клетки все в большей степени удовлетворяет условиям эквипотенциальности.
|
|
|
|
Рис.5. Клетка грамотрицательного микроорганизма в однородном электрическом поле а-линии тока в культуральной жидкости, б-падение потенциала в области клеточных мембран |
|
В самом деле, рассмотрев изменение характера межмолекулярных связей в микробной биомассе при ее высушивании (переход от электростатических к донорно-акцепторным взаимодействиям), можно прийти к выводу об обязательной электризации последней, что и было подтверждено нами экспериментально (путем непосредственного измерения заряда методом динамического конденсатора). Как показали исследования, заряд биомассы может при сушке изменять свой знак, достигая значений не менее 10-9 Кл/м2 для остаточных влажностей 1—2%.
При гиперосмотических воздействиях уменьшение объема клеток (а значит, и геометрических размеров мембран) вследствие их дегидратации должно в результате флексоэлектрического или пьезоэлектрического эффектов также приводить к изменению трансмембранного потенциала. Таким образом, осмотический шок для микробной клетки оказывается одновременно и шоком электрическим.
Аналогичный по форме эффект уменьшения размеров клеток имеет место при концентрировании или разбавлени микробных культур [11]. Эксперименты, поставленные на культурах прокариотических (E. coli) и эукариотических (Torulopsis utilis) клеток продемонстрировали возрастание размеров клеток при увеличении концентрации суспензии и наоборот.
Наконец, тепловой шок, сопровождаясь изменением эффективной диэлектрической проницаемости мембраны в силу сегнетоэлектрических свойств ее структурных компонентов, приводит опять-таки к изменению трансмембранного потенциала. Следовательно, и в этом случае клетка претерпевает электрический шок. Остановимся на указанном явлении несколько подробней. Как уже отмечалось, в литературе имеются данные о наличии сегнетоэлектрических свойств у ряда молекулярных компонентов биомембран. В частности, сегнетоэлектрические свойства обнаружены у белков (РНКазы, лизоцима, трипсина, уреазы, метгемоглобина) [10, 12, 13] и у фосфолипидов [14].
Диэлектрическая проницаемость e сегнетоэлектриков в параэлектрическом состоянии, т. е. при превышении температуры фазового перехода (точки Кюри), понижается с дальнейшим ростом температуры согласно закону Кюри—Вейсса [15]. Из уравнения Кюри-Вейсса следует, что при постоянном заряде Q трансмембранный потенциал прямо пропорционален температуре. Таким образом, увеличение температуры клетки может приводить к возрастанию трансмембранного потенциала, а следовательно, и к дополнительному синтезу АТФ за счет окислительного фосфорилирования. Очевидно, в области изменения температур, лежащих ниже точки Кюри, нагрев клеток может приводить к понижению степени энергизации мембран. Другими словами, химические последствия нагрева или наложения дополнительного электрического поля поперек клеточной мембраны могут быть идентичными.
Заметим, что рассмотренный механизм обсуждается и в связи с вопросами термоэлектрического преобразования энергии термофильными микроорганизмами, а также другими клетками и клеточными органеллами наряду с фотоэлектрическими и химическими энергетическими источниками клеток [16].
Констатируя важную роль сегнетоэлектрических эффектов биомембран, мы должны помнить и о зависимости указанных эффектов от амплитуды и частоты электрического поля, поскольку сегнетоэлектрики относятся к классу нелинейных диэлектриков. Поляризация подобных структур во внешних полях приводит к диэлектрическому гистерезису (сохранению поляризованного состояния при снятии поля). Диэлектрический гистерезис обусловливает большое тепловое рассеяние энергии внешнего ноля и может приводить к дополнительным тепловым эффектам при наложении на клетки электрических полей.
Обратим внимание также на возможность возникновения в биомембранах пироэлектрического (образования поверхностных зарядов при быстром изменении температуры) и электрокалорического (изменение температуры при наложении внешнего электрического поля) эффектов. Для известных пироэлектриков величина пироэлектрического эффекта может иметь порядок 10-4 Кл/град·м2, а величина электрокалорического эффекта 0,1 град·м/В. Экспериментальные исследования реальных значений для биомембран всех указанных эффектов позволят осуществить выбор адекватного механизма термошока микробной клетки и лучше понять роль и возможности электроадаптации микроорганизмов.
Обнаруженные эффекты побуждают к более углубленному изучению процессов, лежащих в их основе. Обратимся к образу микробной клетки к ее детальному портрету, исполненному как бы в различных живописных техниках.
В микробиологии сложилась достаточно плодотворная традиция представлять микробную клетку в свете того метода или практического приложения, с позиций которого осуществляется подход к данной проблеме. В результате сегодня известно несколько портретов микробной клетки, которые похожи друг на друга не больше, чем фотографический и рентгеновский снимки. Вместе с тем, различные представления микробной клетки находятся в согласии друг с другом, и изучение деталей одного портрета позволяет понять закономерности функционирования системы, изображенной на другом. Так, с появлением светового микроскопа бактерии предстали перед глазами исследователя как крошечные сгустки сначала оптически плотного, а затем и люминесцирующего вещества. Когда появился электронный микроскоп, портрет клетки неузнаваемо изменился, и она стала выглядеть как развитая инфраструктура, детали которой в различной степени контрастируются электронно-плотными веществами.
При изучении или практическом использовании микробного метаболизма клетка выступает, как сложнейший природный биохимический реактор, в котором переплелись разветвленные цепи и циклы химических превращений. При исследовании роста и развития микробных популяций или применении микробной массы в народнохозяйственных целях портрет клетки становится предельно схематическим, характеризуя точку множества, описываемого набором численных параметров.
Наконец, с позиций молекулярной биологии, генетики и кибернетики клетка может быть представлена как некая молекулярная вычислительная машина, которая в отличие от ЭВМ работает исключительно на тепловом движении молекул, причем генетически обусловленные факторы физико-химического сродства компонентов играют роль своего рода программы вычислений.
Разработка перечисленных модельных представлений способствовала ряду исторически важных шагов в развитии теоретической и прикладной микробиологии: созданию таксономической классификации микроорганизмов, развитию иммунофлуоресцентных методов диагностики инфекционных заболеваний, появлению учения об инфраструктуре микробной клетки, разнообразных молекулярно-генетических процессах. Все это вместе взятое обусловило в конечном итоге появление новых отраслей народного хозяйства, использующих методы и подходы технической микробиологии.
Вместе с тем к настоящему времени накопилось достаточно много данных, не укладывающихся в рамки вышеназванных модельных представлений о микробной клетке. Речь идет о значительном числе публикаций, описывающих результаты экспериментов по воздействию на микроорганизмы внешних электрических полей, об инактивации микроорганизмов при различных технологических операциях, при лабораторных работах и в процессе производства бактериальных препаратов, не поддающихся объяснению с позиций общепринятых представлений о механизмах повреждения клеток под действием неблагоприятных факторов окружающей среды. В самом деле, до сих пор при рассмотрении физико-химических явлений, имеющих место при обезвоживании микробных культур, в научной литературе [17, 18, 19] учитывались: а) метаболические сдвиги, происходящие в клетках при снижении активности воды; б) повреждение клеточных стенок вследствие прорыва через них внутриклеточной воды и воздействия различных технологических устройств; в) губительное действие кислорода атмосферы, находящее отражение в процессах, сопровождающихся перекисным окислением липидов и образованием свободных радикалов.
Однако такое фундаментальное явление, как изменение электрического заряда клеточной биомассы вследствие неравновесного разделения зарядов двойного электрического слоя при перераспределении молекул воды в гидратных оболочках клеток, по имеющимся у нас сведениям, не принимается во внимание. Другими словами, выполнение технологических операций, а также природные процессы, приводящие к высыханию микробных культур, неизбежно сопровождаются действием на клетки электрических полей нефизиологической природы, т. е. не обусловленных нормальной жизнедеятельностью клеток. Более того, действие внешних полей (например, атмосферного электричества, обычно электризованных поверхностей почвы и растительного покрова, атмосферных осадков и т. д.) вообще является экологической нормой, которой определена своя роль в эволюции животного и растительного мира, в том числе и микрофлоры. Попытки осмысления указанных факторов приводят к выводу о необходимости создания портретов микробной клетки еще одного типа, на которых было бы отражено распределение электрических зарядов и областей с различающимися пассивными электрическими характеристиками (электропроводностью и диэлектрической проницаемостью).
Сохраняя все закономерности, присущие процессам межфазного перераспределения элементарных носителей электричества [2, 20, 21], образование электрического заряда микробных клеток вместе с тем происходит совершенно по-разному в зависимости от характера окружающей среды. В водных или сильно увлажненных гетерогенных средах, когда клетка сильно гидратирована, факторами, определяющими ее поверхностный заряд, являются ионогенные группы структурных компонентов клеточной стенки, химический состав окружающей среды, функциональное состояние физиологических систем клеток. Поверхностный заряд микроорганизмов формируется благодаря ионизации поверхностных структур, имеющих в силу амфотерности кислотно-основной характер.
Как показал Жуков [22], поверхностный заряд микробных клеток определяется соотношением констант ионизации кислотных и основных групп и степенью гидратации поверхности. Отсюда, а также из представлений о дискретной структуре поверхностного заряда вытекает, что даже в изоэлектрической точке и точке нулевого заряда плотность ионов электролита вблизи поверхности отличается от их объемной плотности в культуральной (дисперсионной среде). Это, в свою очередь, обусловливает высокую поверхностную электропроводность микробных клеток при значениях рН, отвечающих изоэлектрической точке и точке нулевого заряда. Поверхностная же электропроводность играет важнейшую роль при ряде взаимодействий микроорганизмов с электрическим полем: электрооптических эффектах [23], дисперсии диэлектрической проницаемости и электропроводности суспензий микроорганизмов, термоэлектрических явлениях, возможно, при фазовых переходах в области поверхностных структур, при электро- и диполофорезе микробных клеток [2], при электросорбции микроорганизмов и вирусов [24, 25, 26, 27].
Тот факт, что электроповерхностные свойства биочастиц в основном определяются полиэлектролитами, обладающими амфотерными свойствами, а в случае микроорганизмов и клеток еще и функциональным состоянием их физиологических систем, обусловливает многообразный характер зависимости поверхностного заряда от рН и ионного состава окружающей среды, наличия в среде ингибиторов ферментов электронного транспорта и окислительного фосфорилирования.
Благодаря количественному превалированию кислотных групп над основными на поверхности большинства биочастиц изоэлектрические точки последних находятся в области низких значений рН, и соответственно при рН, близких к 7, микрочастицы биологического происхождения заряжены отрицательно. Асимметрия кислотно-основных свойств особенно ярко выражена у галофильных бактерий, в поверхностных структурах которых количество кислых аминокислот в несколько раз; превышает долю основных.
Повышение концентраций в окружающей среде катионов (тем более многовалентных) при постоянном рН приводит к снижению величины отрицательного заряда и даже к перезарядке поверхности биочастиц. Исследования, проведенные, в частности, на клетках грамположительных бактерий Streptococcus faecalis (pI 2,3), выявили повышение эффективности неорганических катионов (в указанном выше смысле) в следующем ряду: К+, Na+<Ca2+<Pb2+<H+<Cu2+<Cr3+<Fe3+, Th4+ [28]. Автором было также обнаружено аналогичное действие органических катионов (возрастание эффективности с увеличением силы основания) цетилтриметиламмония и пяти типов акридиновых катионов.
Существенное влияние на электроповерхностные характеристики микроорганизмов оказывают растворенные в среде полиэлектролиты. Так, В. М. Фомченков с соавт. [29], экспериментируя на клетках Escherichia coli НВ-1100, обнаружил изменения электрофоретической подвижности (ЭФП) клеток и электрооптического эффекта при добавке катионных (полидиметилдиаллиламмонийхлорид), нейтральных (по- лиоксиэтилен) и анионных (полиакриловая, полиметакриловая кислоты, карбоксиметилцеллюлоза) полимеров. По мере увеличения концентрации катионных полиэлектролитов происходит уменьшение ЭФП вплоть до нуля и в дальнейшем изменение направления электрофореза клеток. Анионные полимеры обусловливают увеличение ЭФП, а нейтральные - уменьшение. Указанные данные аналогичны зависимостям, известным в коллоидной химии [30, 31, 32].
Еще большие изменения, чем ЭФП, претерпевает электрическая поляризуемость микроорганизмов при адсорбции полиэлектролитов [29, 333]. Объясняя уменьшение электрооптического эффекта при адсорбции бактериями катионных полимеров уменьшением электропроводности клеток, В. М. Фомченков с соавт. [29] выдвигает предположение о значимости эффектов замещения малых противоионов на большие и уменьшения сквозной электропроводности клеток. Последнее объяснение представляется менее убедительным по соображениям малой значимости вклада сквозной проводимости (ниже будет показано, что цитоплазматические мембраны имеют проводимость на несколько порядков меньше, чем внеклеточная среда).
Исследование электрокинетических свойств бактерий в тщательно контролируемых условиях позволяет выявить природу и количество ионных и неионных компонентов на поверхности клеток [34]. Для расшифровки природы поверхностных групп клеточных оболочек Дуглас и Шоу [35] предложили ряд характеристических кривых зависимости между электрофоретической подвижностью и рН для различных ионогенных поверхностных групп (NH3+, СОО- и др.) и неионогенных поверхностей, которые получили впоследствии широкое экспериментальное подтверждение для различных микроорганизмов.
Обращает на себя внимание тот факт, что для многих ионогенных поверхностей наблюдается отсутствие зависимости подвижности клеток от рН в физиологических пределах изменения этого параметра. Изучение изменений электрофоретической подвижности клеток в зависимости от рН дисперсионной среды при постоянной ионной силе позволило охарактеризовать поверхностные структуры клеток Klebsiela aerogenes [36], E. coli [37] ряда культур рода Bacillus [35, 38], сульфатвосстанавливающих [39] и многих других бактерий.
Деккер с соавт. [40] показал, что кривые зависимости между электрофоретической подвижностью и рН для четырех штаммов Salmonella typhi коррелировали с четырьмя типами дифференциации их серологическими методами, что позволило авторам выявить соотношение между поверхностным зарядом бактерий и их антигенной структурой. В дальнейшем было подтверждено, что хотя различные штаммы одного организма имеют в общем очень похожие поверхностные компоненты, тем не менее относительное количество их варьирует от штамма к штамму. Исключение из этого правила представляет семейство Mycobacteriaceae, у которого кривые зависимости рН-подвижности для многих штаммов совпадают независимо от возраста организма и условий его культивирования. Это свидетельствует о том, что все изученные микобактерии имеют идентичные поверхностные компоненты.
Переходя от коллоидно-химических трактовок к современным данным по молекулярной организации клеточных мембран [34, 41, 42], обратим внимание на то, что поверхностные структуры содержат множество молекулярных компонентов, обеспечивающих при ионизации в водных средах достаточно высокий поверхностный заряд и соответственно электрокинетический потенциал (ζ-потенциал).
Важнейшая роль в формировании электрокинетических свойств микробных клеток принадлежит белкам. У грамположительных бактерий заряд определяется главным образом ионизированными группами белков клеточных стенок, жгутиковых белков — флагеллинов, а также молекулами тейхуроновой и тейхоевых кислот. В случае грамотрицательных микроорганизмов наиболее существенный вклад в поверхностный заряд клеток вносят компоненты липополисахарид-липополипротеинового комплекса клеточной оболочки, белковые молекулы некоторых ферментов, белки жгутиков и пилей. Среди грамотрицательных бактерий наибольший набор белков мембраны характерен для клеток Е. coli. В их число входит белок Брауна (липопротеид, составляющий около 35% от структурных компонентов внешней мембраны и гидрофильных пор). Матриксный белок (белок 4) из-за экранировки фосфолипидами вряд ли вносит существенный вклад в Е;-потенциал. Видимо, большую роль в формировании электрического заряда клеток играет белок 7, являющийся рецептором для колицинов и покрывающий около 30% поверхности внешней мембраны [41].
Относительное содержание многих белков бактерий зависит от штамма, состава питательной среды, температуры выращивания, фазы роста. Соответственно возможны вариации поверхностного заряда микроорганизмов, обусловленные, кроме всего прочего, еще наличием капсул, фимбрий, а также тем, в какой форме (S- или R-) находится культура. Так, показано, что отрицательный поверхностный заряд клеток Е. coli снижается в течение первых 4 ч роста в пептонной воде за счет изменения в природе, количестве и расположении поверхностных компонентов [34]. По мере роста заряд клеток увеличивается и достигает постоянного значения к началу стационарной фазы, причем это значение выше для клеток, выращенных в синтетической питательной среде с добавкой аминокислот (аланина или цистеина), чем у бактерий, которые культивировали в питательном бульоне. Клетки Е. coli, выращенные на плотной питательной среде, обладают низкой электрофоретической подвижностью, характерной, по мнению авторов [43], для бактерий, несущих фимбрии (fim+). Бульонная субкультура представляет собой электрокинетически гетерогенную популяцию, состоящую из клеток с уже более высоким зарядом. Длительное субкультивирование в бульоне окончательно формирует гомогенную популяцию fim- клеток с электрофоретической подвижностью в 1, 6...2 раза выше, чем у fim+ клеток. Это явление, очевидно, может быть связано с более высоким сопротивлением среды электрофоретическому движению клеток, несущих фимбрии, и оказывается обратимым. При повторном пассировании fim- клеток на агаре образуется электрокинетически гомогенная популяция fim+ клеток с низкой подвижностью [43].
Удаление фимбрий механическим путем приводит к тому, что заряд клеток становится таким же высоким, как у fim- клеток. Бринтон с соавт. [44] отметил, что подвижность таких дефимбрированных клеток возвращается к своему исходному низкому уровню через 2 ч после помещения в питательную среду, и счел это доказательством того, что фимбрии вновь покрывают поверхность клеток. Иную зависимость поверхностного заряда бактерий от наличия фимбрий отмечал Херманссон с соавт. [45]. Авторы провели электроповерхностных свойств Salmonella thyphimurium и Serratia marcescens методами микроэлектрофореза и ионообменной хроматографии. Было установлено, что клетки S. thyphimurium несут значительно более высокий отрицательный заряд, если они покрыты фимбриями. По всей видимости, единая закономерность изменения электроповерхностных свойств бактерий в зависимости от наличия фимбрий отсутствует.
Данные об электрофоретической подвижности R- и S-вариантов бактериальных культур более однозначны: потеря олигосахаридных компонентов липополисахаридного слоя оболочки (в результате чего формируются шероховатые колонии) приводит к тому, что клетки Е. coli, S. thyphimurium, Kl. aerogenes в R-форме оказываются более заряженными, чем соответствующие гладкие варианты [45, 46, 47].
Отметим, что липополисахаридам (ЛПС), являющимся носителями антигенных свойств, принадлежит существенная роль в кулоновском взаимодействии бактерий с окружающей средой и, в частности, с компонентами иммунной системы макроорганизмов. Так, Якобc [48] на модели ЛПС Е. coli и S. typhimurium и мышиных лимфоцитов показала, что в подобных случаях в первую очередь возникает именно кулоновское притяжение между отрицательно заряженными ЛПС и положительно заряженными поверхностными белками лимфоцитов, которое лишь впоследствии дополняется более сильным взаимодействием ЛПС с мембранными липидами иммунокомпетентных клеток.
Исследование электрофоретической подвижности клеток Е. coli, покрытых капсулами (сар+), показало, что на поверхности капсул доминируют карбоксильные группы при незначительном количестве аминогрупп [36], хотя поверхностная плотность зарядов таких клеток должна быть, очевидно, ниже, чем у некапсулированных. Можно полагать, что заряд сар+ клеток будет иметь меньшую величину, чем у бактерий, лишенных капсул. Это предположение пока не нашло достаточного экспериментального подтверждения, хотя имеются данные о том, что подвижность сар+ клеток Е. coli и Kl. aerogenes не зависит от наличия фимбрий и значительно уступает таковой cap-fim- клеток [43, 44].
Многолетние наблюдения за электрофоретической подвижностью клеток Kl. aerogenes [34] показали, что отрицательный заряд клеток повышается примерно на 10% в экспоненциальной фазе роста, достигая более низкого постоянного для данной культуры значения при переходе ее в стационарную фазу. Аналогичные изменения наблюдались в размере капсул, однако содержание полисахаридов в культуре, напротив, снижалось в логарифмической фазе роста, а затем повышалось до максимального и постоянного значения. Более низкое содержание полисахаридов при большем размере капсул у молодых клеток предполагает более рыхлую («открытую») структуру капсульного материала, с возрастом клеток капсулы сжимаются, происходит переориентация молекул уроновой кислоты — основного носителя отрицательного заряда, в результате чего некоторые карбоксильные группы уже не участвуют в формировании общего заряда клеточной поверхности [49, 50].
Благодаря наличию в структуре молекул полиэлектролитов бактериальные клетки проявляют ионообменные свойства. Например, у Streptococcus aureus обнаружена способность образовывать поверхностные солеподобные лабильные монослои противоионов с одновалентными катионами и более прочные-с двухвалентными [51]. Концентрации подобных противоионов могут быть выше, чем в цитоплазме [52], что обусловливает повышенную электропроводность клеточной стенки.
В последнее время были предприняты попытки непосредственного изучения электрической активности и собственного поля биологических клеток, несмотря на мизерность ожидаемых эффектов. Так, Хисао [53] наблюдал генерацию тока (0,1...0,3 мкА), пропорционального плотности суспензии клеток Е. coli JAM 1016, находившихся в контакте с платиновыми электродами. Автором были исследованы эффекты увеличения тока при добавлении в культуральную среду сукцината, глюкозы, ротенона и антимицина и уменьшения — при добавке арсенита и анионообменной смолы Дауэкс-1. В последнем случае предполагалась конкуренция ионита с электродами при переносе электронов от клеток, в остальных — указывалось на связь эффекта с метаболической активностью микроорганизмов.
Аналогичные исследования с двумя парами электродов ранее выполнил Мацунага [54], наблюдавший пропорциональность разностного тока электродов концентрации живых клеток в разных диапазонах для разных видов микроорганизмов. Авторами была обнаружена зависимость тока от температуры и рН среды.
Поль и Цимерманн [55], экспериментируя с тонкодисперсными порошками, обладающими низкой и высокой (титанат бария) диэлектрической проницаемостью, наблюдали притяжение поляризованных частиц порошка живыми клетками. Таким образом был оценен дипольный момент клетки, оказавшийся равным 10-21 Кл·м. Этот эффект, наблюдавшийся на самых различных биологических клетках, включая бактериальные, свидетельствует о наличии у них переменных электрических полей (по мнению автора, частотой не менее 5 кГц). В противном случае должен бы был иметь место эффект релаксации зарядов за счет их экранировки ионами окружающей среды. Переменное поле, зафиксированное в цитируемой работе, вероятней всего является следствием взаимодействия всех электрических осцилляций, обусловленных функционированием внутриклеточных систем.
Вполне возможно, что поверхностный заряд клеток зависит и от целостности клеточных мембран. Повреждение мембран под действием литических ферментов, детергентов, при резком изменении осмолярности окружающей среды, высушивании-регидратации, замораживании-размораживании, термической инактивации, просто при старении и отмирании клеток приводит к понижению клеточного потенциала [34, 56]. Отмеченное явление объясняется, на наш взгляд, тем, что повреждение клеточных мембран, связанное с возрастанием их проницаемости, а следовательно, и пассивного транспорта между внутри- и внеклеточными пространствами, приводит к понижению трансмембранных разностей потенциалов согласно известному уравнению Гольдмана, являющемуся обобщением уравнения мембранного потенциала Нернста на случай ионов двух видов (например, К+ и Na+), для которых проницаемость мембраны различна.
Показано [57], что бактериальные клетки располагают механизмами активного трансмембранного переноса ионов против градиента концентрации. Кроме того, бактериальная мембрана, так же как и мембрана митохондрии, является генератором электричества, что обусловлено протекающими в ней процессами окислительного фосфорилирования согласно известной электрохимической теории Митчелла.
Работа дыхательной цепи приводит к переносу протонов, в результате чего на мембране возникает разность потенциалов и химическая энергия окисления субстратов превращается в электрическую, как, например, в топливном водородно-кислородном элементе [58].
Помимо сведений об уменьшении заряда клеток при механических, тепловых и химических повреждениях их мембран, имеются экспериментальные данные о снижении мембранных потенциалов клеток при инфицировании их вирусами: клеток стабильных линий KB и HeLa — вирусом Коксаки В-1, бактерий Е. coli — бактериофагом, клеток хорион-аллантоисной оболочки — вирусом гриппа А-2 [59].
Разность потенциалов на мембране, достигая значений 200—300 мВ, обеспечивает возникновение в области клеточных стенок бактерий электрических полей с напряженностью порядка 107 В/м. Такие сильные поля не могут не оказывать ориентирующего влияния на ионизированные компоненты мембран, изменяя конформацию структурно связанных с мембранами биомакромолекул, ориентируя элементарные диполи и упорядочивая тем самым систему поверхностных зарядов клетки. Помимо этого, в столь сильных полях повышается вероятность ионизации функциональных групп, т. е. повышаются эффективные значения констант диссоциации структурных компонентов мембран. Таким образом, повышение проницаемости мембран приводит к снижению мембранных потенциалов, обусловливая тем самым и снижение поверхностного заряда клеток.
Г. А. Остроумовым и Л. Н. Воробьевым [60] рассмотрен еще один механизм влияния трансмембранного потенциала на плотность поверхностного заряда. По мнению авторов, на заряд клеточной поверхности может влиять работа электрогенных помп, а также изменения проницаемости внешней мембраны (через изменение Кт ионизированных субстратов, через концентрации Н' и К+ в водном окружении мембраносвязанных ферментов). Как нам представляется, указанный механизм может приобретать существенное значение в случаях затрудненной конвекции в культуральных жидкостях (при высокой вязкости питательных сред, в тонких пленках и т. д.). К сожалению, до сих пор отсутствуют количественные характеристики влияния трансмембранной разности потенциалов на поверхностный заряд микробной клетки. Правда, Нейхоф и Эшольс [61] показали, что электрофоретическая подвижность интактных клеток Е. coli К-12 и изолированных клеточных стенок этих бактерий в одинаковой степени зависит от изменений рН и ионной силы окружающей среды. Вместе с тем подвижность изолированных клеточных стенок составляет только 90% от значения электрофоретической подвижности целых клеток.
Вирусы, как и бактериальные клетки, имеют на своей поверхности белковые молекулы, определяющие величину и знак суммарного заряда. Спиральные вирусы содержат белок только одного вида, размеры молекул которого определяют диаметр спиралевидной палочки, а число молекул на один виток — шаг спирали. Вирусы, имеющие форму типа тетраэдров, октаэдров, икосаэдров и т. п., содержат в своей оболочке большое число различных белков.
Исследования, выполненные на вирусном материале, например на различных штаммах вируса оспы, обнаружили аналогичное влияние рН и ионной силы буферных растворов на поверхностный заряд вирионов [59]. Белки капсидов вирусов оспы, так же как и других вирусов, имеющие в целом кислую реакцию, обусловили нахождение изоточек в интервале 2,2... 4,4 в зависимости от штамма. Действие на вирус n-толуолсульфонилхлорида благодаря элиминации части поверхностных аминогрупп приводило к резкому смещению изоэлектрической точки вируса в область низких значений рН (с 4,3 до 2,5).
Перенос заряда в высушенных биоструктурах, содержащих полиэлектролиты, представляет собой сумму активированных процессов, главным образом поверхностного характера, развивающихся по экспоненциальному закону с различными характеристическими энергетическими барьерами (энергиями активации). Гидратация указанных структур приводит к сильному увеличению их электропроводности и диэлектрической проницаемости, т. е. понижению потенциальных барьеров [62].
Поверхностная проводимость сухих бактериальных препаратов обусловливается также электропроводностью клеточной стенки. Исследования [4] позволили установить, что предельно сухие бактериальные препараты (например, культуры Е. coli и S. marcescens, высушенные до постоянного веса) представляют собой порошкообразные изолирующие материалы с удельной электропроводностью 10-13...10-12 См-м-1. При увлажнении бактериальных препаратов снижается сначала потенциальный барьер для электронного транспорта, а затем и энергия ионизации функциональных групп на поверхности клеток и в клеточных стенках, а также электролитов, попавших в порошок из культуральной среды. В результате образуется гетерогенная, система, эквивалентная электропроводность которой возрастает с увеличением содержания влаги (до 20% изменения электропроводности на 1 % изменения влажности препарата). Последнее обстоятельство позволило предложить новый метод контроля влажности бактериальных препаратов практически во всем диапазоне реально возможных влагосодержаний [4].
Подчеркнем, что рассмотренные выше закономерности электрических зарядов на поверхности микробных клеток касались условий, когда микроорганизмы находятся в водных средах. Для высушенных аэрозолированных клеток характерны иные механизмы образования поверхностного заряда. По имеющимся представлениям, частицы аэрозолей аккумулируют заряд, соударяясь с аэроионами, а также приобретают его вследствие трения об окружающие среды и тела [63]. Заряд частиц аэрозолей является их размера, концентрации ионов, температуры и влажности газовой среды, времени витания, а в случае трибоэлектрических процессов еще и контактной разности потенциалов между соприкасающимися материалами. Однако в свете данных, полученных нами в последнее время, представляется, что адсорбция аэроионов проявляется главным образом при достаточно больших временах витания, тогда как непосредственно при переводе препаратов в аэрозольное состояние возникновение заряда обусловлено другими механизмами, связанными с неравновесным разделением заряда двойного электрического слоя вследствие быстрого испарения молекул воды с поверхности частиц, а также трибоэлектрическими эффектами.
Измерения заряда аэрозолированных бактерий S. marcescens показали, что его величина колеблется в пределах 1...20 элементарных электрических зарядов [64] в зависимости от относительной влажности воздуха. На поверхности частиц происходит непрерывным обмен молекул воды, находящейся в равновесии с водяным паром воздуха. В результате этого при относительных влажностях воздуха выше 50% заряд быстро релаксирует, а при влажностях ниже 30% он сохраняется сравнительно долгое время. По мере испарения молекул воды увеличивается плотность заряда в расчете на единицу площади поверхности частицы, однако величина заряда будет уменьшается в результате притяжения аэроионов противоположного знака [65]. Клетки Е. coli, распыленные из водной суспензии в комнатных условиях, в большинстве своем (на 90%) заряжены отрицательно, тогда как 30% бактерий, выделенных из естественного аэрозоля, несут положительный заряд [66], что, по нашему мнению, связано с различным аэроионным окружением в обоих случаях, а также с различным временем витания.
Перевод в аэрозольное состояние приводит к изменению электроповерхностных свойств бактерий, на что указывают данные по изменению электрофоретической подвижности Е. coli (MRE, штаммов 160 и 162), осажденных из аэрозоля [67, 68].
Электрические заряды возникают не только на внешней поверхности клетки, но и с внутренней стороны цитоплазматической мембраны, а также на внутриклеточных элементах инфраструктуры микроорганизма (ядрах, нуклеоидах, плазмидах и других органеллах). В этом находит свое проявление фундаментальный характер закономерностей образования двойных электрических слоев на межфазных границах. Наличие заряда на всех структурных неоднородностях, на всех органеллах клеток приводит к тому, что цитоплазма оказывается буквально пронизанной силовыми линиями внутриклеточных электрических полей. Если учесть, что эти поля являются неоднородными, то становится очевидной, в частности, роль процессов внутриклеточного электро- и диполофореза биомакромолекул, т. е. линейных и квадратичных по полю электромиграционных процессов, привносящих дополнительное упорядочение в распределение ионизированных и поляризованных компонентов цитоплазмы (в том числе молекул ферментов, нуклеиновых кислот).
Таким образом, становится неоспоримой роль электрических феноменов в специфической организации и компартментализации функциональных систем клеток, причем заметим, что роль эта первична, поскольку кулоновские и пондеромоторные силы являются дальнодействующими. Проявление этих сил ослабляется расклинивающим действием гидратных оболочек микроструктур и биоколлоидов. Из-за этого, а также из-за теплового движения ионов и молекул электростатические силы не приводят к образованию устойчивых агрегатов. Вместе с тем внутриклеточные градиенты электрического поля клетки резко увеличивают вероятность одних и снижают вероятность других локализаций в цитоплазме молекул и ионов, что весьма существенно с биохимической и физиологической точек зрения. В итоге есть все основания говорить об электроиммобилизации ряда эндоферментов, что наряду с другими эффектами межмолекулярного взаимодействия приводит к образованию целых ферментных систем, структурно связанных с мембранами. Роль электрических феноменов в нормальной жизнедеятельности микробной клетки не исчерпывается рассмотренными явлениями и находит отражение также в метаболической и двигательной активности микроорганизмов [69, 70].
Отталкиваясь от наиболее простой электрической модели микробной клетки (непроводящей микросферы, обладающей поверхностным электрическим зарядом) и проанализировав ряд электрических феноменов клетки и эффектов ее взаимодействия с окружающей средой и полями, мы приходим еще к одному портрету микробной клетки, на котором она предстает как сложнейшая органическая интегральная микросхема, снабженная к тому же автономной микроэлектростанцией.
Безусловно, электрическая инфраструктура и электрозависимые биохимические процессы, играя первостепенную роль в жизнедеятельности микроорганизмов, оказываются теми мишенями микробных клеток, которые могут атаковываться внешними электрическими полями (в том числе и полями других клеток, принадлежащих к данной популяции).
Таким образом, имеются все основания говорить об электроадаптации бактерий к стрессовым факторам как о вполне определенном, фундаментальном явлении. При этом определенно следует полагать, что механизм электроадаптации совершенствовался в ходе эволюции, в процессе выживания микробных популяций при изменении условий внешней среды, различных природных катаклизмах.
Вместе с тем, из вышеизложенного с очевидностью следует, что ультратонкие черты электрического портрета бактериальной клетки, особенно, если последняя находится в жидкой среде, могут проявляться только в ее тесном взаимодействии с молекулами и полимолекулярными агрегатами, кластерами, воды. В свою очередь, сегодня ни у кого не вызывает сомнения факт влияния электрических полей на инфраструктурное состояние воды. Таким образом, мы приходим к предположению, что воздействие внешних электрических полей одновременно на воду и микробную клетку может играть какую-то роль в механизме электроадаптации последних к стрессу. Вместе с тем, если принять во внимание, что молекулы воды в гидратных оболочках клеток уже структурированы под воздействием сильных локальных электрических полей поверхностных клеточных структур, то следует заключить, что влияние слабых внешних полей не должно радикально изменять структуру воды в ближних зонах клеток.
Вместе с тем на основании рис.5 с учетом двойной экранировки внутриклеточных структур от постоянных электрических полей малой интенсивности мы должны прийти к выводу о реальности эффектов реструктуризации только для межклеточной воды. Далее приходится констатировать, что роль реструктуризации воды под воздействием постоянного электрического поля при микробиологических эффектах может заключаться, главным образом, в изменении условий транспорта электронов в межклеточном пространстве. Это наше утверждение базируется на изложенных выше модельных представлениях для микробной клетки и том факте, что в зоне гидратных оболочек матриксных элементов клеток действуют электрические поля намного более высокой напряженности, чем рассматриваемые в данном случае внешние электрические поля. Тогда закономерен вопрос, участвует ли фактор структурной модификации внеклеточной воды в тех глубоких трансформациях микробных клеток, которые мы наблюдаем при электроадаптации последних к стрессовым ситуациям.
Для выполнении корректного эксперимента потребовалось создание установки для электрической реструктуризации воды, исключающей ее химическую модификацию, как это обычно происходит при катодной или анодной активации воды. Мы использовали для данной цели разработанную и запатентованную нами в России, а также 15 западно-европейских странах аппаратуру для электросорбционной обработки гетерогенных жидкостей. Технология «электроуправляемой сорбции» уже применяется нами для децентрализованной доочистки и очистки воды хозяйственно-питьевого назначения. На базе указанной технологии был разработан и запущен в производство модельный ряд «электрокондиционеров воды «Каскад»® (см. рис.6, www.elecotec.com). При этом указанная аппаратура решает проблему реструктуризации воды с понижением ее окислительно-восстановительного потенциала (ОВП). Разработанная технология позволяет достигать вышеуказанного эффекта при обработке достаточно больших объемов воды без неизбежного обогащения ее продуктами катодных реакций и связанного с ним неизбежного смещения рН воды в щелочную область, как это делается на большинстве известных сегодня установок.
В результате многочисленных экспериментов, проводившихся на двухкамерных электролизерах был достаточно хорошо изучен механизм электрохимической активации воды, связанный с электродными процессами на анодах и катодах. Подобные эффекты ярче проявляются при наличии в воде растворенных электролитов, но в любом случае требуют больших затрата энергий (порядка десятков кВт∙ч на 1 м3 обрабатываемой воды) и при получении надежных эффектов наблюдаются заметные сдвиги рН в кислую (при анодной активации) или щелочную (при катодной активации) области.
|
|
|
||
|
|
а |
б |
|
|
Рис.6. Электрокондиционеры различной производительности. а - малые модели (производительность от 100 до 1000л/ч); б - модель, рассчитанная на обработку до 5000 л/ч |
|||
Вместе с тем, интересные возможности для электроактивации воды открываются на другом конце энергетической шкалы - в области низких энергетических воздействий. В этой области концентрационные изменения электрически активных компонентов (ионов, радикалов) за время обработки не достигают существенных размеров, но жидкокристаллическая структура воды трансформируется таким образом, что заметно снижается ОВП и биологическая активность воды.
В результате исследований, проводившихся нами на протяжении многих лет, достоверно установлено, что при пропускании воды через рабочую камеру электрокондиционеров «Каскад» происходит, не только очистка от многих видов загрязнений, но и существенное понижение ОВП обрабатываемой воды. ОВП уменьшается с +(250...450) мВ, присущих, как правило, необработанной природной или водопроводной воде, до значений близких к 0 или даже на несколько десятков мВ боле низких. После более интенсивной электрообработки (более длительной или при более высоких значениях межэлектродной разности потенциалов) ОВП воды может достигать и более низких значений - до -200...-300 мВ и ниже. Эти эффекты наблюдаются и на слабо и умеренно минерализованной воде, и даже на воде, дистиллированной или деионизованной другими методами. При кипячении или выдерживании воды в течение некоторого времени (от 6 до 24 ч) ОВП воды постепенно возвращается к исходному значению, имевшему место до электрообработки.
Весьма показательна картина электроактивации воды в электрокондиционере, которая иллюстрирует достаточно слабую зависимость эффекта снижения ОВП от времени обработки (скорости потока воды через рабочую камеру) , или количества электрического введенного в единицу объема (см. табл. 3).
Таблица 3
Зависимость между ОВП воды и временем воздействия электрического поля
|
Линейная скорость потока, см/мин |
0 (контроль) |
6 |
24 |
60 |
|
Напряжение на электродах,В |
0 |
12 |
12 |
12 |
|
Ток, А |
0 |
0,9 |
0,9 |
0,9 |
|
Значение ОВП воды, мВ |
420 |
-10 |
0 |
5 |
Из табл. 3 видно, что снизить ОВП более чем на 400 мВ удается при удельных энергозатратах различающихся в 10 раз. В данной ситуации, конечно, представляет интерес выяснение пороговых условий для возникновения эффекта структурных изменений в объеме воды и связанного с этим существенного понижения ОВП.
Практически отсутствующая зависимость величины снижения ОВП от количества рассеянной энергии в (данном диапазоне значений) свидетельствует об отличии результирующего эффекта трансформации воды, от тех, что изучены при униполярной катодной или анодной обработке воды.
Другое отличие наблюдается в характере связи между эффектом снижения ОВП и степенью ее минерализации. Как следует из табл. 4, эффект снижается по мере повышения степени минерализации (или электропроводности как меры минерализации). Было также показано, что этот эффект в подавляющем большинстве практических случаев практически не зависит от природы присутствующих в воде катионов и анионов. Исключения могут составить только сильно минерализованные воды, из которых при электролизе выводятся ионы в воздушную фазу или в осадок, образуются сильные окислители.
Данные табл. 4 свидетельствуют о том, что слабым электрическим воздействиям, приводящим к снижению ОВП, подвергаются непосредственно полимолекулярные структурные субъединицы воды, и шунтирование электрического тока через систему ионами солей заметно ослабляет это воздействие в результате увеличивающегося рассеяния энергии в растворах.
Электродные же процессы, изменяя химический состав воды, то есть соотношение между активностями окисленной и восстановленной форм химических соединений, приводят к увеличению ОВП.
Таблица 4
Зависимость между ОВП воды и временем воздействия электрического поля
|
Удельная электропроводность воды, мкСм∙см-1 |
62(контроль) |
11 |
62 |
202 |
255 |
353 |
502 |
|
Напряжение на электродах |
0 |
12 |
12 |
12 |
12 |
12 |
12 |
|
Ток, А |
0 |
0,1 |
0,6 |
2,0 |
2,5 |
3,5 |
5,0 |
|
Значение ОВП воды, мВ |
380 |
-13 |
-10 |
54 |
61 |
369 |
378 |
Интересно сопоставить полученные результаты по снижению ОВП воды данным других наших опытов, проведенных на жидких бактериальных культурах при стрессовых, адаптирующих к стрессу и деструктивных воздействиях: влияние на ОВП культур Escherichia cоli М-17 таких травмирующих операций, как центрифугирование, осмотический и тепловой шок, замораживание-размораживание, кипячение, воздействие ультразвуком и электрическим током. При всех воздействиях, если они не сопровождались гибелью и деструкцией бактериальных клеток, ОВП жидких культур несколько снижался. Это согласуется с рассмотренной выше явлением дегидратации клеток при стрессе и соответственно поступлением во внеклеточную среду структурированной внутриклеточной воды с пониженным ОВП.
Но только при воздействии постоянного электрического тока наблюдалось аномально большое снижение ОВП (на 400-500 мВ) [71]. Контрольные эксперименты, поставленные на бесклеточных культуральных средах, не выявили изменений ОВП при пропускании электрического тока, что, в принципе, соответствует картине иллюстрируемой табл. 4. В самом деле, увеличение ОВП при высоких значениях электропроводности воды обусловлено электродными процессами на анодах и катодах. В рассматриваемой же работе использовалась трехкамерная электрохимическая ячейка, в которой рабочая (центральная) камера отделена полупроницаемыми мембранами от катодной и анодной камер с циркулирующим буферным раствором, и продукты электродных реакций, приводящие в случае однокамерной ячейки к отмечавшемуся увеличению ОВП, практически не могли попадать в исследуемую жидкость.
Совсем иная картина возникает при воздействии поля на микробные популяции, которые суспендированы в культуральных средах, содержащих минимальное количество электролитов или средах, приготовленных на воде, прошедшей предварительную обработку полем в электрокондиционере. Во всех опытах, проведенных на различных штаммах: Е. coli, S. marcescens, St. aureus 209, Enterobacter cloaceae, Klebsiela aerogenes, Pseudomonas maltophilia CCEB 715 и др. наблюдалась усиленный рост, превышающий контрольные данные на 50-300%, как при высеве на плотные питательные среды, так и при высушивании в тонком слое, гиперосмотическом шоке, замораживании-размораживании, действии антибиотиков и детергентов.
Таким образом, отмечая важную роль надмолекулярных ассоциированных структур воды во всех физиологических реакциях микробных клеток, возникающих под воздействием слабых электрических полей, мы можем констатировать и заметный вклад параллельного процесса реструктуризации межклеточной воды в культурах микроорганизмов при низких ионных силах культуральных сред.
Литература
1. Андреев В.С., Дронова Н.В., Карякин А.А. и др. // Сб. тр. Главмикробиопрома, 1982, вып. №5, стр. 66-80
2. Духин С.С., Дерягин Б. В. Электрофорез. М.: Наука, 1976, стр. 328
3. Кульский Л. А., Дэйнега Ю.Ф., Савлук О.С. и др. // Коллоид. журн., 1980, вып. №4, стр. 755-761
4. Андреев В.С., // Приборное оснащение и автоматизация биологических исследований: тез. Всесоюз. конф. 1981, стр. 88.
5. Reaveley D.A., Burge R.E. // Adv. Microbiol. Physiol., 1972, Vol. 148, p. 781-788.
6. Поликар А. Молекулярная цитология мембранных систем животной клетки. М.: Мир, 1972, стр. 63.
7. Работнова И.Л. // Успехи микробиологии, 1975, вып. №10, стр. 120-126.
8. Андреев В.С., Дронова Н.В., Попов В.Г. // Тез. VII съезда Всесоюзн. микробиол. об-ва, 1985, т.2 стр. 9.
9. Эль-Регистан Г.И., Дуда В.И., Козлова А.Н. и др. // Микробиология, 1979, т. 48, стр. 240-245.
10. Mascarenhas S. // An. Acad. brasil. ciкnt., 1975a, Vol. 47, p. 223-229.
11. Андреев В.С., Галицын А.А.Ю Попов В.Г. // Биотехнология, 1990, N.I, стр.39-43
12. Mascarenhas S. // J. Electrostatics, 1975b, Vol. 1, p. 141-145.
13. Ahmed A. // Collect. Phenom., 1976, Vol. 2, p. 155-159.
14. Jain M.K., Wagner R.G. // Introduction to biological membranes. N.Y.: Willey, 1980, p. 36-61.
15. Лайнс М., Гласс А. Сегнетоэлектрики и родственные им материалы. М.: Мир, 1981, стр. 456.
16. Mullet A. // Phys. lett., 1983, Vol. 6, p. 319-324.
17. Лыков А.В. Теория сушки. М.: Энергия, 1970, стр. 472
18. Долинов К.Е. Основа технологии сухих биопрепаратов. М.:Медицина, 1969, стр. 343.
19. Бекер. М.Е., Домберг Б.Э., Раппопорт А. И. Анабиоз микроорганизмов. Рига: Зинатне, 1981, стр. 253.
20. Андреев В.С. // Проблемы создания аппаратуры для медицинских лабораторных исследований, 1974, ч. 4, стр. 5-17.
21. Богуславский Л.И. Биоэлектрохимические явления и граница раздела фаз. М.: Наука, 1978, стр. 360.
22. Жуков А. Н. // Коллоид, журн., 1982, Вып. 1, стр. 122-124.
23. Стоилов С., Шилов В. М., Духин С.С. и др. Электрооптика коллоидов. Киев: Наук. думка, 1977, стр. 200.
24. Гвоздяк П.И., Гарбара С.В., Чеховская Т.П. // Микробиология, 1977а, вып. №1, стр. 118-122.
25. Гвоздяк П.И., Могилевич Н.Ф., Никоненко В.У. // Прикл. биохимия и микробиология, 1977б, вып. №2, стр. 295-298.
26. Андреев В.С., Попечителев Е.П. // Проблемы создания аппаратуры для медицинских лабораторных исследований: Тез. докл. II Всесоюз. конф., 1979, стр. 19-21.
27. Имшенецкий А.А., Мурзаков Б.Г., Дорофеева И.К. // Микробиология, 1983, вып. №1, стр. 140-144.
28. Shott H. // Bioelectrochem. Bioenerg. 1977, vol. 4, p. 117-136.
29. Фомченков В.М., Ажермачев А.К., Чугунов В.А., Бабаева П.В. // Коллоид, журн., 1983, вып. №2, стр. 273-280.
30. Bush P.L., Stumm W. // Environ. Sci. and Technol., 1968, vol. 2, p. 49-53.
31. Treweek G.P., Morgan Y.Y. // Coll. Intern. Sci., 1977, vol. 60, p. 258-263.
32. Платонов Б.Э., Соловьева Т.Е. // Коллоид, журн., 1981, вып. 6, стр. 1104-1109.
33. Иванов В., Стоилов С., Сореков С., Пенканчин И., // II конгр. Микробиол., Наука и Техника, 1971, стр. 52-53.
34. James A. // Adv. Colloid and Interface Sci., 1982, vol. 15, p. 171-221.
35. Douglas T., Shaw D. // Trans. Faraday Soc., 1958, vol. 54, p. 1748-1754.
36. Gittens G., James A. // Biochim. et. biophys. acta., 1963, vol. 66, p. 237-243.
37. Davies J., Haydon D., Rideal E. // Proc. Roy. Soc. London B., 1978, vol. 145, p. 375-381.
38. Гузев В.С., Звягинцев Д.Г. // Микробиология, 1973, вып. 4, стр. 708-712.
39. Улановский И.Б., Руденко Е.К., Супрун Е.А., Леденев А.В. // Микробиология, 1980, вып. 1, стр. 117-121.
40. Dekker W.A., van der Meer C., Scholtens R. // Antonie van Leewenhoek J. Microbiol. Set. B. 1942. Vol 8. p. 53-59.
41. Солтон М. // Молекуляр. микробиология, 1977, стр. 420-453.
42. Варбанец Л.Д. // Микробиол. журн., 1980, вып. №5, стр. 661-670.
43. James A., List C. // Biochim. et biophys. acta., 1966, vol. 112, p. 307-313.
44. Brinton C., Buzzell A., Lauffer M. // Biochim. et biophys. acta., 1954, vol. 15, p. 533-539.
45. Hermansson M., Kjelleberg S., Korhoben T., Stenstrom T. –A. // Arch. Microbiol., 1982, bd. 131, s. 308-312.
46. Moyer L. // J. Bacteriol., 1936, vol. 31, p. 531-536.
47. James A. // Progress in Biophysiscs and Biophysical Chemistry, 1957, vol. 3, p. 98-112.
48. Jacobs D.M. // Rev. Infect. Diseases, 1984, vol. 6, N 4, p. 501-505.
49. Plummer D., James A. // Biochim. et biophys. acta., 1961, vol. 53, p. 453-461.
50. James A., Loveday D., Plummer D. // Ibid., 1964, vol. 79, p. 351-360.
51. Gutinelli C., Galdiero F. // J. Bacteriol., 1967, vol. 6, p. 2022-2023.
52. Carstensen E.L. // Biophys. J., 1967, vol. 7, p. 493-503.
53. Hisao M. // J. Gen. and Appl. Microbiol., 1982, vol. 1, p. 73-86.
54. Matsunaga T., Karube I., Suzuki S. // Appl. Environ. Microbiol., 1979, vol. 1, p 117-121.
55. Pohl H.A., Zimmermann U. // Chem. Eng. News, 1982, vol. 60, p. 20-21.
56. Цвид Е.Е., Шкоп Я.Я., Позмогова И.Н. // Микробиология, 1981, т. 50, стр. 659-664.
57. Котык А., Яначек К. Мембранный транспорт. М.: Мир.1980, стр. 312.
58. Лукоянова М.А., Тихонова Г.В. // Итоги науки и техники. Биол. химия, 1982, вып. 17, стр. 3-21.
59. Землянский В.В. // Микробиолог. журн., 1978, №5, стр. 619-622.
60. Ostroumov G.A., Vorobiev L.N. // J. Theor. Biol., 1978, vol. 75, p. 289-297.
61. Neihof R., Echols W. // Biochim. et. biophys. acta., 1973, vol. 318, p. 23-29.
62. Gascoyne P., Pethig R., Szent-Gyorgyi A. // Proc. Nat. Acad. Sci. US, 1981, vol. 1, p. 261-265.
63. Shutz A. // Staub. Reinhalt. Luft., 1967, bd. 27, N12, s. 534.
64. Orr C., Gordon M. // J. Bactriol., 1956, vol. 71, p. 315-319.
65. Zajic J., Inculet I., Martin P. // Space and terrestrial Biotechnology, 1982, p. 51-60.
66. Luckiesh M., Taylor A., Holladay L. // J. Bacteriol., 1946, vol. 51, p. 52-55.
67. Hambleton P. // J. Gen. Microbil., 1970, vol. 61, p. 197-203.
68. Benbough J. // J. Gen. Microbil., 1972, vol. 72, p. 511-521.
69. Konings W., Helligwert K., Robillard G. //Membrane transport: New Comprehensive Biochemistry, 1981, p. 257-283.
70. Либерман Е.А. Живая клетка. М.:Наука, 1982, стр. 78.
71. В.С.Андреев, Н.В.Дронова, Поварков Ю.Н., В.Г.Попов. // Биотехнология. 1991, №2, стр. 48-52.